
分析 (1)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,机会热化学方程式书写;
(2)依据化学平衡三段式结合平衡常数=生成物浓度的幂次方之积比上反应物浓度的幂次方之积、转化率=$\frac{转化量}{起始量}$×100%进行列式计算;
(3)欲使平衡向正反应方向移动且反应速率加快改变的条件需要增大反应物的浓度、增大压强等措施;注意温度降低平衡正向进行,但速率减小.
解答 解:(1)黄铁矿(主要成分为FeS2)其燃烧产物为SO2和Fe2O3,1g FeS2完全燃烧放出7.1kJ热量,480gFeS2完全燃烧放出3408kJ热量,反应的热化学方程式为:
4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol;
故答案为:4FeS2(s)+11O2(g)$\frac{\underline{\;高温\;}}{\;}$2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol;
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.依据平衡三段式列式计算;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103;
故答案为:依据平衡三段式列式计算;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=$\frac{0.0{4}^{2}}{0.0{1}^{2}×0.01}$=1.6×103;
(3)欲使平衡向正反应方向移动且反应速率加快;
A.向平衡混合物中充入Ar,容器中总压增加,分压不变,平衡不动,故A不符合;
B.向平衡混合物中充入O2,增大反应物的浓度平衡正向进行,反应速率增大,故B符合;
C.改变反应的催化剂,对平衡无影响,平衡不动,故C不符合;
D.降低反应的温度,反应速率减小,故D不符合;
故答案为:B.
点评 本题考查了热化学方程式书写方法,化学平衡的定量计算,平衡常数和转化率概念的应用,图象分析画法的分析应用,题目难度中等.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
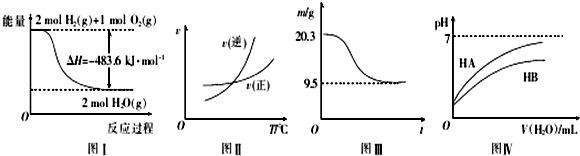
| A. | 图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ.mol-1 | |
| B. | 图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应 | |
| C. | 图Ⅲ表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云通常是用小黑点来表示电子的多少 | |
| B. | 能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动 | |
| C. | 处于最低能量的原子叫基态原子 | |
| D. | 电子仅在激发态跃迁到基态时才会产生原子光谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②④⑤ | C. | ②③⑤⑥ | D. | ③④⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com