
分析 (1)根据水溶液中或熔融状态下能够导电的化合物称为电解质分析;
(2)①从海水中提取镁的原料:海水、石灰乳,②制硅酸盐水泥的原料:石灰石和黏土,③制普通玻璃的原料:石英砂、石灰石、纯碱等,④制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,⑤生产陶瓷的原料是粘土;
(3)根据碱性氧化物与酸反应产物为相应的盐和水分析;
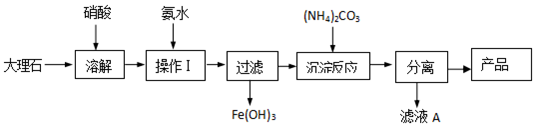
(4)大理石(含少量的Fe2O3杂质),加入硝酸溶解后的溶液中加入氨水沉淀铁离子生成氢氧化铁,过滤得到硝酸钙溶液,加入碳酸铵发生沉淀反应生成碳酸钙,分离得到碳酸钙固体和滤液A,滤液A”中除H+离子外,还含有的阳离子是铵根离子,据此分析.
解答 解:(1)①石灰石(主要成分CaCO3)是混合物,不是电解质;
②CaO 是熔融状态下能导电的化合物,属于电解质;
③CO2 本身不能发生电离,是非电解质;
④H2O 能发生电离,是电解质;
⑤Ca(OH)2悬浊液是混合物,不是电解质;
⑥CaCO3是熔融状态下能导电的化合物,属于电解质;
故答案为:②④⑥;
(2)①从海水中提取镁的原料:海水、石灰乳,正确,②制硅酸盐水泥的原料:石灰石和黏土,正确,③制普通玻璃的原料:石英砂、石灰石、纯碱等,正确,④制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉,正确,⑤生产陶瓷的原料是粘土,错误;
故答案为:⑤;
(3)生石灰可与盐酸发生反应CaO+2HCl=CaCl2+H2O,根据碱性氧化物的概念属于碱性氧化物;
故答案为:碱性;CaO+2HCl=CaCl2+H2O;
(4)溶解大理石时,用硝酸而不用硫酸的原因是硫酸钙微溶于水;滤液A”中除H+离子外,还含有的阳离子是铵根离子,检验铵根离子的方法为:取少量滤液A与烧碱溶液在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,试纸变蓝说明溶液中有铵根离子;
故答案为:硫酸钙微溶于水;NH4+;取少量滤液A与烧碱溶液在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,若试纸变蓝,则可证明.
点评 本题围绕石灰石考查学生物质的分类、化学方程式的书写、碳酸钙制备流程分析判断等知识,注意知识的归纳和梳理是解题的关键,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O/mL | 品红溶液 | 现象 |
| ① | 4.0 | 0 | 0 | x | 3滴 | 较快褪色 |
| ② | 0 | 4.0 | 4.0 | 0 | 3滴 | 不褪色 |
| ③ | 4.0 | 0 | 4.0 | 0 | 3滴 | 缓慢褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Sc3+ | Ti3+ | Fe2+ | Cu2+ | Zn2+ |
| 颜色 | 无色 | 紫红色 | 浅绿色 | 蓝色 | 无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 不论以何种方式使反应体系的压强增大,化学反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度将缩短反应到达平衡的时间 | |
| D. | 当该反应到达平衡时,SO2、O2、SO3都存在于反应体系中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
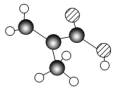 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③④⑥ | C. | ②③④⑥ | D. | ⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com