
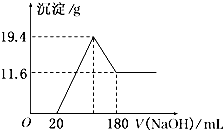
 将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.
将可能含有少量碳、硅杂质的a克镁铝合金投入100mL一定物质的量浓度的盐酸中,合金部分溶解,过滤,向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入氢氧化钠溶液的体积的关系如图所示.| n |
| V |
| 7.8g |
| 78g/mol |
| 11.6g |
| 58g/mol |
| 0.8mol |
| 0.1L |
| v |
| vm |
| 0.112L |
| 22.4L/mol |
| 1 |
| 2 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、相同温度时,在水中的溶解性:NaHCO3>Na2CO3 |
| B、与Ca(OH)2溶液反应:Na2CO3溶液中有白色沉淀生成,NaHCO3溶液中没有沉淀生成 |
| C、热稳定性:NaHCO3<Na2CO3 |
| D、相同物质的量浓度时,溶液的导电能力:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增大NO2或CO的浓度 |
| B、减小CO2或NO的浓度 |
| C、通入Ne使气体的压强增大 |
| D、升高反应的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40gNaOH溶解于1L水中配成NaOH溶液 | ||
| B、常温常压下将22.4LHCl气体溶于水配成1L的盐酸溶液 | ||
C、将1L0.5mol/L的浓盐酸加热浓缩为
| ||
| D、从1000ml1mol/L的NaCl溶液中取出100ml的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等体积、等浓度的Ba(OH)2溶液与KAl(SO4)2溶液混合:3Ba2++6OH-+2 Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
| B、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、Fe3O4与稀硝酸反应的离子方程式为:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、向NaOH溶液中加入金属铝:Al+2OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜铸塑像上出现铜绿[Cu2(0H)2C03] |
| B、用石膏点豆腐 |
| C、不良商贩用硫黄熏蒸法制作“白豆芽” |
| D、自来水厂用氯气对水进行消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com