
【题目】(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第____周期.第___族;PbO2的酸性比CO2的酸性_____(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_________________________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为________________,阴极上观察到的现象是_______________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________,这样做的主要缺点是__________________。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量—a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m:n值_______。

【答案】六 ⅣA 弱 PbO2+4HCl(浓)△PbCl2+Cl2↑+2H2O PbO+ClO-![]() PbO2+Cl- Pb2++2H2O—2e-
PbO2+Cl- Pb2++2H2O—2e-![]() PbO2↓+4H+ 石墨上包上铜镀层 Pb2++2e-
PbO2↓+4H+ 石墨上包上铜镀层 Pb2++2e-![]() Pb↓ 不能有效利用Pb2+ 根据PbO2△PbOx+(2—x/2)O2↑,有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2·nPbO,2m+n/m+n=1.4,m:n=2/3
Pb↓ 不能有效利用Pb2+ 根据PbO2△PbOx+(2—x/2)O2↑,有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2·nPbO,2m+n/m+n=1.4,m:n=2/3
【解析】
(1)根据题给信息知,铅是碳的同族元素,比碳多4个电子层,碳位于第二周期,则铅在元素周期表的位置为第六周期、第ⅣA族;根据同主族元素性质递变规律判断,PbO2的酸性比CO2的酸性弱;
(2)根据题意知,PbO2与浓盐酸共热生成黄绿色气体氯气,迁移二氧化锰与浓盐酸的反应知,反应的化学方程式为PbO2+4HCl(浓)△PbCl2+Cl2↑+2H2O;
(3)根据题给信息知,PbO与次氯酸钠溶液反应生成PbO2和氯化钠,反应的离子方程式为PbO+ClO-![]() PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e-
PbO2+Cl-;根据题给信息知,电解池阳极发生氧化反应,即Pb2+失电子被氧化生成PbO2,电极反应式为Pb2++2H2O—2e-![]() PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e-
PbO2↓+4H+,阴极上发生还原反应,电极反应式为:Cu2++2e-![]() Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e-
Cu↓,观察到的现象是石墨上包上铜镀层;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为Pb2++2e-![]() Pb↓,这样做的主要缺点是不能有效利用Pb2+;
Pb↓,这样做的主要缺点是不能有效利用Pb2+;
(4)根据题给信息知,PbO2在加热过程发生的反应为PbO2△PbOx+(2—x/2)O2↑,则有(2—x/2)×32=239×4.0%,x=2—(239×4.0%/16)=1.4,根据mPbO2·nPbO,2m+n/m+n=1.4,m:n=2/3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中﹣lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
(已知:Ksp(ZnS)=3×10﹣25mol2/L2)

A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=10﹣35.4mol2/L2
D. 向100 mLZn2+、Cu2+浓度均为10-5mol/L的混合溶液中逐滴加入10-4mol/L的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为 2.0L 的恒容密闭容器中发生如下反应:A(g)![]() B(g)+C(g)
B(g)+C(g) ![]() H>0。
H>0。
起始物质的量(mol) | 平衡物质的量(mol) | |||||
容器 | 温度(℃) | A(g) | B(g) | C(g) | 达到平衡所需时间(s) | |
Ⅰ | T1 | 0.20 | 0.10 | 0.10 | t1 | |
Ⅱ | T2 | 0.40 | t2 | |||
Ⅲ | T3 | 0.20 | 0.15 | 0.15 | t3 | |
下列说法正确的是( )
A.达到平衡的时间:t3>t1
B.反应达到平衡时,A 的转化率:容器Ⅱ>容器
C.反应达到平衡时,容器 I 中的平均速率为 v(A)=(0.10/t1)mol/(L·s)
D.T1 时,该反应的平衡常数为 0.05
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。实验时按如下步骤操作:

实验原理是:Cu2S+O2=SO2+2Cu,通过测定SO2的量来确定Cu2S的质量分数。
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2+2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_______________________;装置②的作用是_________________________
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为_______________________________________________________。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是____________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是___________(写一种即可)。
(5)某人设想以右图所示装置用电化学原理生产硫酸, 写出通入SO2的电极的电极反应式___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体和白色不溶物.某同学设计了如下实验方案并验证产物、探究反应原理。
(1)提出假设
实验1:用砂纸擦去镁条表面的氧化膜,将其放入盛有适量滴有酚酞的饱和碳酸氢钠溶液的试管中,迅速反应,产生大量气泡和白色不溶物,溶液由浅红变为红.该同学对反应中产生的白色不溶物进行如下猜测:
猜测1:白色不溶物可能为_________;
猜测2:白色不溶物可能为MgCO3.
猜测3:白色不溶物可能是碱式碳酸镁[xMgCO3yMg(OH)2].
(2)设计定性实验确定产物并验证猜测:
实验序号 | 实验 | 实验现象 | 结论 |
实验Ⅱ | 将实验Ⅰ中收集到的气体点燃 | 能安静燃烧、产生淡蓝色火焰 | 气体成分为___①______ |
实验Ⅲ | 取实验Ⅰ中的白色不溶物,洗涤,加入足量____②_____ | _____③____ | 白色不溶物可能含有猜测2中不溶物 |
实验Ⅳ | 取实验Ⅰ中的澄清液,向其中加入少量CaCl2稀溶液 | 产生白色沉淀 | 溶液中存在 _____④____ |
(3)为进一步确定实验1的产物,设计定量实验方案,如图所示:

称取实验1中所得干燥、纯净的白色不溶物22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部通入装置A和B中.实验后装置A增重1.8g,装置B增重8.8g,试确定白色不溶物的化学式:_________;(4)请结合化学用语和化学平衡移动原理解释Mg和饱和NaHCO3溶液反应产生大量气泡和白色不溶物的原因:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]()
![]()
![]() 在密闭容器反应,达到平衡状态的标志是( )
在密闭容器反应,达到平衡状态的标志是( )
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A.(1)(2)(3)(4)(5)B.(2)(3)(4)C.(1)(3)(4)(5)D.(1)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚邻苯二甲酸二烯丙脂(DAP-A)是一种优良的热固性树脂,这种材料可以采取下列路线合成:
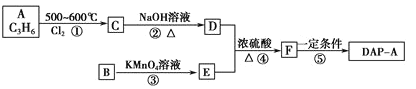
已知: DAP-A的结构简式为: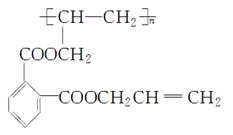
(1)反应①~④中,属于取代反应的是___________________。
(2)写出有关反应的化学方程式:
反应②_________________________________________________________;
反应④_________________________________________________________。
(3)G是E的同分异构体,G具有如下性质:①能发生银镜反应,且1 molG与银氨溶液反应时最多可得到4molAg:②遇FeCl3溶液呈紫色:③在稀硫酸中能发生水解反应。则符合上述条件的G最多有_____________种,请写出其中一种的结构简式___________________,该物质有___________________种不同化学环境的氢。
(4)工业上可由C经过两步反应制得甘油,试仿照题目中合成流程图的形式。写出这一合成过程:_______________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 25 ℃时部分弱电解质的电离平衡常数数据如下表:
化学式 | HSCN | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)写出碳酸的主要的电离方程式_________________。若将碳酸饱和溶液稀释10 倍,则稀释后的溶液中 c(H+)______原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为_______(用编号填写)。
a.CH3COONa b. Na2CO3 c. NaClO d.NaHCO3 e.NaSCN
(3)常温下,有浓度均为1 mol·L-1的下列4种溶液:①H2SO4溶液②NaHCO3溶液③NH4Cl溶液④NaOH溶液,其中由水电离的H+浓度由大到小的顺序是__________。(均填序号)
(4)常温下,几种弱电解质的pK(pK=-lg K)如下表所示:
电解质 | H3BO3 | CH3NH2 | HN3 | H2CrO4 |
pK | 9.3 | 3.4 | 4.7 | pK1=0.74,pK2=6.5 |
请回答下列问题:
①硼酸(H3BO3)在水中存在电离平衡:H3BO3+H2O![]() B(OH)4-+H+。由此推断,硼酸是___(填字母)。
B(OH)4-+H+。由此推断,硼酸是___(填字母)。
a.一元酸 b.三元酸 c.强酸 d.弱酸
②常温下,在H3BO3、HN3、H2CrO4中酸性最强的是______________(填化学式)。
③H2CrO4的二级电离常数表达式Ka2=_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的是
实验目的 | 实验步骤 | |
A | 检验溶液中是否存在 | 用洁净的玻璃棒蘸取少量溶液在酒精灯上灼烧,观察火焰颜色 |
B | 检验久置的 | 取样配成溶液,加入盐酸酸化,再加 |
C | 检验碳单质与浓硫酸反应的产物 | 将反应生成的气体依次通过无水硫酸铜粉末、澄清石灰水、品红溶液 |
D | 检验碘盐中是否含有碘元素 | 取样配成溶液,加入淀粉溶液,观察溶液是否变蓝 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com