
【题目】铁粉和氧化亚铁粉末的混合物共9.2克,加入到150毫升的稀硫酸中,恰好完全反应,得到氢气2.24升(标准状况).求:
(1)混合物中铁和氧化亚铁的质量?
(2)原稀硫酸的物质的量浓度?
【答案】
(1)解:n(H2)= ![]() =
= ![]() =0.1mol,
=0.1mol,
Fe+H2SO4=FeSO4+H2↑
1 1
n(Fe) 0.1mol
所以n(Fe)=0.1mol,m(Fe)=5.6g
答:混合物中铁和氧化亚铁的质量分别为Fe 5.6g、FeO 3.6g
(2)解:m(FeO)=9.2g﹣5.6g=3.6g,n(FeO)=0.05mol,
溶质为硫酸亚铁,根据铁元素守恒n(FeSO4)=0.1mol+0.05mol=0.15mol,
所以n(H2SO4)=n(FeSO4)=0.15mol,
C(H2SO4)= ![]() =1mol/L
=1mol/L
答:原稀硫酸的物质的量浓度为1mol/L
【解析】n(H2)= ![]() =
= ![]() =0.1mol,反应的方程式为Fe+H2SO4=FeSO4+H2↑,根据生成氢气的物质的量可计算Fe的质量,进而计算FeO的质量,反应后溶液的成分为FeSO4 , 根据质量守恒可计算硫酸的物质的量,进而计算浓度.
=0.1mol,反应的方程式为Fe+H2SO4=FeSO4+H2↑,根据生成氢气的物质的量可计算Fe的质量,进而计算FeO的质量,反应后溶液的成分为FeSO4 , 根据质量守恒可计算硫酸的物质的量,进而计算浓度.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的电子式为____。
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为____(已知该反应为置换反应)。
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O。KClO4含有化学键的类型为__________,K的原子结构示意图为________。
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为__________________。
(5)100 g上述产气药剂产生的气体通过碱石灰后得到N2 33.6 L(标准状况)。
①用碱石灰除去的物质为____;
②该产气药剂中NaN3的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中充入2mol A、0.6mol C和一定量的B三种气体,一定条件下发生反应2A(g)+B(g)3c(g),各物质的浓度随时间变化的关系如图1所示,其中如t0~t1阶段c(B)未画出.图2为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件. 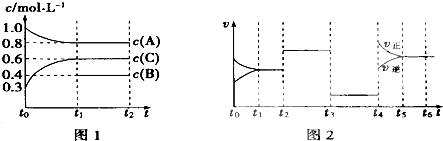
(1)若t1=15min,则t0~t1阶段以c的浓度变化表示的反应速率V(C)= .
(2)t3时改变的条件为 , B的起始物质的量为 .
(3)t4~t5阶段,若A的物质的量减少了O.01mol,而此阶段中反应体系吸收能量为a kJ,写出此条件下该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氮是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的氨氮(用NH3表示)转化为氮气除去,相关反应如下:
① NH3 +HClO===NH2Cl+H2O ② NH2Cl+HClO===NHCl2+H2O ③ 2NHCl2 +H2O===N2+HClO+3HCl
已知在水溶液中NH2Cl较稳定,NHCl2不稳定易转化为氮气。在其他条件一定的情况下,改变![]() (即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是
(即NaClO溶液的投入量),溶液中次氯酸钠去除氨氮效果与余氯(溶液中+1价氯元素的含量)影响如右图所示。则下列说法正确的是

A. 次氯酸与氨的总反应可表示为:2NH3+3HClO===N2+3H2O+3HCl
B. 反应中氨氮去除效果最佳的n(NaClO)/n(NH3)值约为1.5
C. a点之前溶液中发生的主要反应为:NH2Cl+HClO===NHCl2+H2O
D. 次氯酸钠溶液pH较小时有O2生成,促使氨氮去除率提高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有以下物质①熔融状态的NaCl ②NH3·H2O ③Na2O固体 ④铜 ⑤BaSO4固体 ⑥酒精 ⑦液态HCl ⑧KNO3溶液,其中属于电解质的是:___________;该状态下能导电的是_____________;属于非电解质的是_________________。(请用序号作答)
(2)以下A~D四个涉及H2O2的反应,请填空:
A. Na2O2+ 2HCl=H2O2+2NaCl B. Ag2O+H2O2=2Ag+O2↑+H2O
C. 2H2O2=2H2O+O2↑ D. □H2O2+□KMnO4+□H2SO4→□MnSO4+□K2SO4+□H2O+□O2↑
①配平D方程式,系数填在方框内____;该反应的还原剂是_________________;
②H2O2既体现氧化性,又体现还原性的反应是________,H2O2既不作氧化剂又不作还原剂的反应是__________。(请用代号作答)
③请用双线桥法表示B反应中电子转移的方向和数目:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废电池外壳中回收锌(锌皮中常有少量铁、外表沾有NH4Cl、ZnCl2、MnO2等杂 质),制取ZnSO4·7H2O可以采取如下工艺流程:

已知:①Zn(OH)2和Al(OH)3化学性质相似;②金属氢氧化物沉淀的pH:
氢氧化物 | 开始沉淀的pH | 完全沉淀的pH |
Zn(OH)2 | 5.7 | 8.0 |
Fe(OH)3 | 2.7 | 3.7 |
请回答下列问题:
(1) “酸溶”时,为了提高酸溶速率,可采取的的措施有:______________(任答一点)。
(2)“氧化”时,酸性滤液中加入NaNO2反应的离子方程式为______________。
(3) “氧化”时,为了减少污染,工业上常用H2O2替代NaNO2。
①若参加反应的NaNO2为0.2 mol,对应则至少需要加入10%H2O2溶液_______________mL(密度近似为1g·cm-3)。
②该过程中加入的H2O2需多于理论值,原因除了提高另外反应物的转化率外,还可能是_____________。
(4) “调节pH”时,若pH>8则造成锌元素沉淀率降低,其原因可能是________________。
(5)将滤渣A溶于适量稀硫酸,调节溶液pH,过滤,将滤液蒸发浓缩,冷却结晶析出ZnSO4·7H2O晶体。则该过程中需调节溶液pH的范围为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从柑桔中可炼制萜二烯( ![]() ),下列有关它的推测不正确的是( )
),下列有关它的推测不正确的是( )
A.分子式为C10H16
B.常温下呈液态难溶于水
C.所有原子可能共平面
D.与过量溴的CCl4 溶液反应后产物(如图)为: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10mL0.1mol LCaCl2溶液中滴加0.1mol L 的Na2CO3溶液,滴加过程中溶液中-lgc(Ca2+)与Na2CO3 溶液体积(V)的关系如图所示,下列有关说法正确的是

A. Z 点对应的分散系很稳定
B. w、x、y三点中,水的电离程度最大的为y点
C. 若用等浓度的Na2SO4 溶液代替Na2CO3 溶液,则图像在x点后的变化如虚线部分所示
D. Ksp(CaCO3])=5 x 10-10mol2/L2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:

(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式_____________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式__________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:

已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为______。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
(7)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com