
| A. | 60周年国庆阅兵车HQE顶级红旗采用全铝车身,铝的氧化物属于两性氧化物 | |
| B. | 用热的纯碱溶液洗涤沾有油污的器具时发生的主要是化学变化 | |
| C. | 英国华裔科学家高锟因在“光在纤维中的传输应用于光学通信方面”做出了突破性成就,而获得了2009年诺贝尔物理学奖,光纤制品的基本原料为SiO2 | |
| D. | 液氨、液氯、液态氯化氢都是非电解质 |
分析 A.氧化铝能与酸、碱反应生成盐与水,属于两性氧化物;
B.油脂在碱性条件下发生水解反应生成高级脂肪酸盐与甘油;
C.二氧化硅是制备光导纤维的基本原料;
D.液氯属于单质,既不是电解质越不是非电解质,液态HCl属于电解质.
解答 解:A.氧化铝与酸反应生成盐与水,与碱反应生成盐与水,属于两性氧化物,故A正确;
B.纯碱溶液呈碱性,油脂在碱性条件下发生水解反应生成高级脂肪酸盐与甘油,故B正确;
C.二氧化硅是制备光导纤维的基本原料,故C正确;
D.液氨属于非电解质,而液氯属于单质,既不是电解质越不是非电解质,液态HCl属于电解质,故D错误,
故选:D.
点评 本题考查两性氧化物、盐类水解与油脂性质、二氧化硅的用途、电解质与非电解质,比较基础,注意对基础知识的理解掌握.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 制取等量的硝酸铜,需硝酸的量②最少 | |
| B. | 制取等量的硝酸铜,②产生的有毒气体比①少 | |
| C. | 三种方案中,硝酸的利用率为③>①>② | |
| D. | 三种方案的反应都可以在铁质容器中进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (一种常见化妆品的防霉剂),其生产过程如下图(反应条件没有全部注明):
(一种常见化妆品的防霉剂),其生产过程如下图(反应条件没有全部注明):
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36 L | B. | 28 L | C. | 22.4 L | D. | 11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
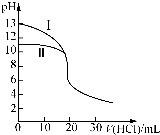 室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )
室温下,用0.10mol•L-1盐酸分别滴定20.00mL 0.10mol•L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示.下列说法不正确的是( )| A. | Ⅱ表示的是滴定氨水的曲线,当V(HCl)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-) | |
| C. | 滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 (弱碱性,易被氧化)
(弱碱性,易被氧化) 中官能团的名称氨基、羧基,②的反应类型是取代反应.
中官能团的名称氨基、羧基,②的反应类型是取代反应. 的同分异构体的结构简式
的同分异构体的结构简式 .
. +nH2O.
+nH2O. 的合成路线.
的合成路线.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则(1)溶液中一定含有的阳离子有H+、NH4+、Mg2+、Al3+,一定不含有的离子有CO32-、NO3-、Fe3+.
100mL某溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①若加入锌粒,会产生H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则(1)溶液中一定含有的阳离子有H+、NH4+、Mg2+、Al3+,一定不含有的离子有CO32-、NO3-、Fe3+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com