
化合物AB中含B为33.3%,化合物BC2中含B为50%,则化合物ABC4中含B为
[ ]
科目:高中化学 来源: 题型:
 (2011?崇川区三模)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
(2011?崇川区三模)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. ]-
]- ]-
]-| 1 |
| 8 |
| 270 | ||
|
| 270 | ||
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
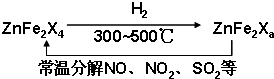
| a |
| Vd-a |
| 1000a |
| 35V |
| 1000b |
| V |
查看答案和解析>>
科目:高中化学 来源: 题型:
(20分)有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
① 3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、 “II”或“III”) 。
② X的结构简式是 。
③ l mol F在中充分燃烧,生成
和
的物质的量之比为8:3,消耗7.5mol
,其核磁共振氢谱中有3个吸收峰,且能与
反应生成
。
F分子中含有的含氧官能团的名称是 。
Y+FZ反应的化学方程式是 。
(
、
代表烃基或氢原子)
合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个。
① AB反应的化学方程式是 。
② BC的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氯原子。C的结构简式是 。
③ P的结构简式是 。
④ 符合下列条件的B的同分异构体共有(填数字) 种。
a.在酸性条件下水解为M和N b.一定条件下M可以转化为N
⑤已知:(R代表烃基或氢原子)
A的同系物W的相对分子质量为44。请参照示例写出以W和另一种有机物为原料合成肉桂醇()的合成路线: 。
查看答案和解析>>
科目:高中化学 来源:辽宁省模拟题 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com