
【题目】下面的排序不正确的是( )
A. 晶体熔点的高低:
B. 熔点由高到低:Na>Mg>Al
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
科目:高中化学 来源: 题型:
【题目】下列电离方程式中不正确的是( )
A.H2SO4═2H++SO ![]()
B.Ba(OH)2═Ba2++2OH﹣
C.NaNO3═Na++NO ![]()
D.KClO3═K++Cl﹣+3O2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
A. 催化剂V2O5不改变该反应的逆反应速率
B. 增大反应体系的压强,反应速率一定增大
C. 该反应是放热反应,降低温度将缩短反应达到平衡的时间
D. 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种电池的正极材料,可通过下列方法制得:①称取一定量的固体铁氧体磁性材料溶于过量盐酸,接着先后加入双氧水和氢氧化钠溶液,静置24h,过滤
②将沉淀加入反应瓶中,加入过量的氢氟酸溶液,80℃恒温加热24ha
③蒸发多余氢氟酸和水,得淡红色FeF3凝胶
④在干燥箱中,以100℃预处理6h,最后掺入铁氧体磁性材料混合研磨制得正极材料
(1)加入双氧水的作用是(用离子方程式表示)
(2)步骤②的反应瓶材质可能是(填序号)
A.玻璃
B.陶瓷
C.聚四氟乙烯
(3)加氢氟酸反生反应的化学方程式为
(4)从安全的角度考虑,在实验室里制三氟化铁时应在中进行
(5)三氟化铁与Li在固体电解质铁氧体中发生置换反应,产生的电流可供电脑使用,该电池反应的化学方程式为
(6)取上述铁氧体样品溶于足量盐酸,在通入标准状况下672mL C12 , Fe2+恰好被完全氧化成Fe3+ , 然后把溶液蒸干,灼烧至恒重得9.6g固体,则该铁氧体的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示.由图中所给数据进行分析: 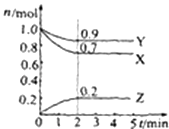
(1)该反应的化学方程式为;
(2)反应从开始至2分钟末,用Z表示该反应的平均反应速率;
(3)反应达平衡时X的转化率: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1mol?L﹣1的NaOH溶液中:K+、Na+、SO ![]() 、CO
、CO ![]()
B.0.1mol?L﹣1的Na2CO3溶液中:K+、Ba2+、NO ![]() 、Cl﹣
、Cl﹣
C.0.1mol?L﹣1的FeCl3溶液中:K+NH ![]() 、I﹣、SCN﹣
、I﹣、SCN﹣
D.0.1mol?L﹣1的盐酸中:Fe2+、Na+、Br﹣、NO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在周期表中1~36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子.Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态.
(1)按电子排布,Q元素在周期表中属区.
(2)第一电离能YZ,电负性YZ(填“>”,“=”或“<”).
(3)W与Z形成的常见化合物有W2Z、W2Z2 , W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6…,W2Z分子中Z原子的杂化类型为 , YW3分子的立体构型为 , YW3极易溶于W2Z的主要原因有 .
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 .
(5)Q+与Y3﹣形成的晶胞结构如图所示,阴、阳离子间的核间距为 a pm,阿伏伽德罗常数用NA 表示,则晶体的密度为gcm﹣3 . 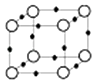
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.强电解质溶液的导电能力一定比弱电解质溶液强
B.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸
C.将氢氧化钠和氨水溶液各稀释一倍,两者的OH﹣浓度均减少到原来的 ![]()
D.如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com