
| A. | NaCl溶液 | B. | 盐酸 | C. | 硫酸 | D. | KSCN溶液 |
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
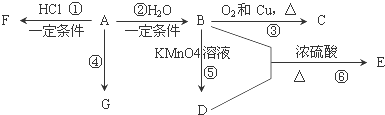
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量Mg(OH)2固体可溶于较浓的NH4Cl溶液中:Mg(OH)2+2NH4+═Mg2++2NH3•H2O | |
| B. | 在CuSO4溶液中加入PbS,可转变为铜蓝(CuS):Cu2++PbS═Pb2++CuS | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓ | |
| D. | 向Na2S2O3溶液中滴加稀硫酸,溶液变混浊:S2O32-+2H+═S↓+SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
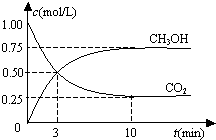
| A. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| B. | 从反应开始到平衡,氢气的转化率为75% | |
| C. | 该密闭容器的体积为1L | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
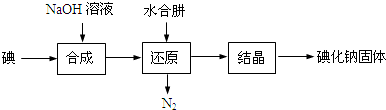
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
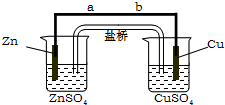 某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:
某学生利用下面实验装置探究盐桥式原电池的工作原理.按照实验步骤依次回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
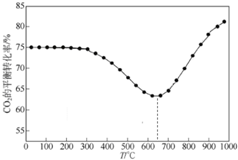 CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.
CO2是自然界中碳循环的主要载体,维持大气中CO2的平衡对生态环境有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com