
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是

已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
【答案】B
【解析】
A.100 mL 0.5 mol/LCa(CIO)2溶液,恰好与0.05molCO2反应生成CaCO3和HClO, 0.01 mol CO2通入溶液时,CO2为不足量,发生反应的化学方程式依然是Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,A正确;
B.当通入0.1 mol CO2后,100 mL 0.5 mol/LCa(CIO)2溶液,恰好与0.1molCO2反应生成Ca(HCO3)2和HClO,由物料守恒可知:c(H2CO3)+c(HCO3-)+c(CO32-)=1mol/L,c(HClO)+c(ClO-)=1mol/L,由题中的公式可求得
![]() ,
,
![]() ,比较它们的倒数,可知c(H2CO3)<c(HClO),B错误;
,比较它们的倒数,可知c(H2CO3)<c(HClO),B错误; ![]()
C.久置后,次氯酸分解生成盐酸和氧气,盐酸能与碳酸钙反应,导致体系中沉淀减少,C正确;
D.缓慢通入0.05 mol CO2的过程中,发生反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,Ca(ClO)2电离出的ClO-促进水的电离,生成的HClO电离出的H+能抑制水的电离,缓慢通入0.05 mol CO2的过程中,ClO-转化为HClO,,故水的电离程度一直减小,D正确;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用,可以获得多种有机物。化合物A含有碳、氢、氧3种元素,其质量比是12:3:8。液态烃B是一种重要的化工原料,其摩尔质量为78 gmol-1。E是有芳香气味的酯。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
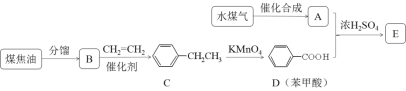
请回答:
(1)化合物A所含的官能团名称是_____________。
(2)B和CH2=CH2反应生成C的反应类型是_____________。
(3)E在氢氧化钠溶液中水解的化学方程式是_____________。
(4)下列说法正确的是_____________。
A.将铜丝在空气中灼烧后迅速插入A中,反应多次,可得到能发生银镜反应的物质
B.在一定条件下,C可通过取代反应转化为![]()
C.苯甲酸钠(常用作防腐剂)可通过D和氢氧化钠反应得到
D.共a mol的B 和D混合物在氧气中完全燃烧,消耗氧气大于7.5a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL NaOH溶液中通入一定量的CO2后,在继续向该溶液中逐滴加入0.2 mol·L-1的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如下图所示
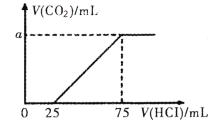
下列有关说法不正确的是
A.原溶液中NaOH的物质的量浓度为0.15 mol·L-1
B.0~25 mL发生的离子反应为:OH-+ H+ =H2O
C.通入CO2后所得的溶液中溶质的物质的量之比为1:1
D.纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两种物质相互作用,反应条件或者反应物用量改变,不会引起产物种类改变的是( )
A.Na和O2B.NaOH和CO2C.Fe和Cl2D.HCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
(1)向沸水中逐滴滴加1 mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是____________nm。
(2)电子工业需要用30 %的FeCl3溶液腐蚀敷在绝缘板上的铜片制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式______________________________________。某同学对FeCl3腐蚀铜后所得溶液的组成进行测定:取少量待测溶液,滴入KSCN溶液呈红色,则溶液中所含金属阳离子有________________。
(3)若要验证该溶液中含有Fe2+,正确的实验方法是________(用字母代号填)。
A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe2+。
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,证明含有Fe2+。
C.向试管中加入试液,先滴入KSCN溶液,无现象,再滴加氯水,若显血红色,证明原溶液中含有Fe2+
(4)欲从废液中回收铜,并重新获得FeCl3溶液设计实验方案如下:

①写出上述实验中有关物质的化学式:A:__________;B:__________。
②写出通入 C的化学方程式_____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
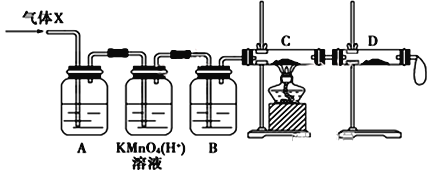
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的污染臭名昭著,含硒的化学药物却有望迎来美名。某环保车间将含SO2、NO烟气经O3预处理后用CaSO3水悬浮液吸收。O3氧化烟气中SO2、NOx的主要反应的热化学方程式为
NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9 kJ·mol-1
NO(g)+1/2O2(g)=NO2(g) △H=-58.2 kJ·mol-1
SO2(g)+O3(g)=SO3(g)+O2(g) △H=-241.6kJ·mol-1
(1)实验表明,在常温下反应:3NO(g)+O3(g)=3NO2(g)正向自发,试说明原因:_____。
(2)将NO与H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其转化过程如图所示,试写出反应I的离子反应方程式:___________,反应II的离子方程式:________________。
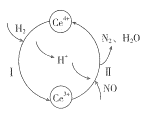
(3)用CaSO3水悬浮液处理二氧化氮,若在吸收液中加入Na2SO4溶液,能提高NO2的吸收速率,其主要原因是___________;达到平衡后,溶液中c(SO32-)=__________[用c(SO42-、Ksp(CaSO3)和Ksp(CaSO4)表示]。
(4)氮的氧化物还可以通过电解法处理获得氮气和氧气,电解质为固体氧化物陶瓷,据图写出阴极的电极反应方程式:_______________。

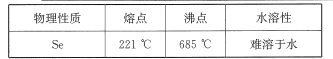
(5)已知 SeO2与SO2的混合烟气用水吸收可制得单质硒,过滤得粗硒,硒的部分物理性质如下表所示。某工艺采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_____。
(6)最近我国学者锁定COVID-19的新靶点Mpro蛋白酶,通过先进筛选手段,在FDA批准的已上市和临床实验药物中,发现老药Ebselen(![]() )在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________
)在细胞实验中展现出优异的抗病毒效果,优于此前研究者设计的多种冠状病毒Mpro蛋白酶的抑制剂N3,这两类药物都是抑制病毒的核苷酸的复制。Ebselen抑制病毒复制的最佳浓度为_____________![]() ,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。
,比较N3半数有效浓度有无与伦比的优势。从影响化学反应速率的因素分析,这类药物的作用原理为_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草酸亚铁水合物A可用于制作照相显影剂、制药等。下面是对该化合物的制备及分析的实验方案。

请回答下列问题。
(1)硫酸亚铁的制备及收集纯净的氢气:将2.00g铁粉(含少量FeS及其他难溶性杂质)放入150mL锥形瓶中,加入25mL 3 mol/L H2SO4,水浴加热。反应完毕趁热过滤,反应装置如下图所示(每个装置限用一次)。
①使用以上装置完成实验,指出装置连接顺序:a______________。
②反应完毕后趁热过滤的目的是________________________。
(2)草酸亚铁水合物A的制备:将滤液转移至事先已盛有50 mL 1 mol/L H2C2O4溶液的250mL烧杯中,搅拌下加热至沸腾,一段时间后得到淡黄色沉淀(其主要成分为A)。
①已知A中铁的质量分数为31%,其化学式为____________。
②3.6g A 在无氧条件下加热,最终得到1.44g 固体化合物,试写出该过程中发生反应的化学方程式:___________________________。
③若对实验方案中的硫酸加入量略作调整,可以得到更高产率的A,试用化学平衡的相关知识分析,并指出该调整是增加还是减少硫酸的量:________。
(3)草酸亚铁水合物A纯度的测定:称取mg产物于100mL烧杯中,用2 mol/L H2SO4溶解,转移至250 mL容量瓶中并用2 mol/L H2SO4定容。移取25.00mL溶液至 250 mL 锥形瓶中,微热后用浓度为c mol/L的标准高锰酸钾溶液滴定,平行测定三次,平均消耗滴定剂VmL(假设杂质不参与滴定反应)。
①写出滴定过程中发生反应的离子方程式:___________________________ ;
②列出表示产物中A的纯度的计算式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O
(实验内容及记录)
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/L H2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 1.0 | 2.0 | 4.0 |
2 | 2.0 | 3.0 | 1.0 | 2.0 | 5.2 |
3 | 1.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据表中的实验数据,可以得到的结论是____。
(2)利用实验1中数据计算,所在时间内用KMnO4的浓度变化表示的平均反应速率为:v(KMnO4)=____。
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。
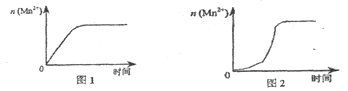
①该小组同学提出的假设是____。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 1.0 | 2.0 | ___ | t |
③若该小组同学提出的假设成立,应观察到的现象是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com