
 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)分析 (1)化学平衡常数等于生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,WI2的物质的量减少,说明化学平衡逆向移动;
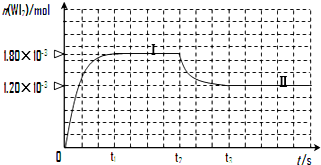
(3)从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$进行计算;
(4)A、达到平衡状态时,各物质的浓度不变,不一定相等;
B、单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明v逆=v正;
C、由于反应物中有气体,只有在平衡状态,密度不变;
D、因前后气体分子数相等,则无论是否达到平衡状态,压强不变.
解答 解:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=$\frac{C(W{I}_{2})}{c({I}_{2})}$,故答案为:$\frac{C(W{I}_{2})}{c({I}_{2})}$;
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,WI2的物质的量减少,说明化学平衡逆向移动,因此正反应方向放热,
故答案为:放热;温度升高,n(WI2)减小,平衡向左移动,所以是放热反应;
(3)从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=$\frac{△c}{△t}$=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1.8×1{0}^{-3}mol}{0.05L}}{3min}$=1.20×10-2 mol•L-1•min-1,
故答案为:1.20×10-2 mol•L-1•min-1;
(4)a、达到平衡状态时,各物质的浓度不变,不一定相等,故a错误;
b、单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明v逆=v正,故b正确;
c、由于反应物中有气体,只有在平衡状态,密度不变,故c正确;
d、因前后气体分子数相等,则无论是否达到平衡状态,压强不变,故d错误;
故选:bc.
点评 本题主要考查温度对化学平衡、化学平衡常数的影响以及平衡的判断,难度不大,考查学生分析和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸钠水溶液中通入少量CO2:2CH3COO-+CO2+H2O═2CH3COOH+CO32- | |
| B. | 向FeBr2溶液中通过量的Cl2:2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 | |
| C. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO${\;}_{4}^{-}$+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )
按如图装置进行电解实验:A极是铜锌合金,B极为纯铜.电解质中含有足量的铜离子.通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68g,溶液质量增加0.04g,则合金中Cu、Zn原子个数比为( )| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (V1+V2+V3)L | B. | (V1+V2-V3)L | C. | (V1+V2-2V3)L | D. | V3-(V1+V2)L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ•mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成塔的燃烧器内中心管道内通入氢气 | |
| B. | 应当控制氯气的用量少于氢气 | |
| C. | 氯气在氢气中燃烧,火焰为蓝色 | |
| D. | 反应需要点火才能进行,因此是一个吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com