
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝溶液,并用于烟气脱硫。
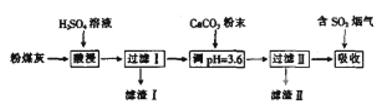
(1) (“能”或“不能”)用NaOH溶液代替H2SO4溶液。
(2)酸浸时反应的离子方程式为
(3)加CaCO3调节溶液的pH至3.6,其目的是 。Al2(SO4)x(OH)6-2x______(填“易”或“难”)于水。
(4)已知粉煤灰中Al2O3的质量分数为40.8%,制得的碱式硫酸铝【Al2(SO4)x(OH) 6-2x】中x=1.5.某实验小组取80.0g粉煤灰进行上述实验,假设在整个过程中铝的损耗率为10%,则可制得碱式硫酸铝的质量为__________g。
【知识点】工艺流程 守恒法应用于化学计算 C2 O5
【答案解析】(1)不能(1分)(2)Al2O3+6H+=2 Al3++3H2O(2分)
(3)中和溶液中的酸并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x;易(1分)
(4)71.7(3分)
解析:(1)粉煤灰的主要成分Al2O3、SiO2都与NaOH溶液反应,不能除去SiO2,所以不能用NaOH溶液代替H2SO4溶液。
(2)酸浸时粉煤灰的主要成分Al2O3与H2SO4反应。
(3)为使粉煤灰与H2SO4反应充分,所加H2SO4溶液过量,因此加CaCO3目的是中和溶液中的酸并使Al2(SO4)3转化为Al2(SO4)x(OH)6-2x
(4)设:可制得碱式硫酸铝的质量为x
根据铝元素守恒:1Al2O3 ____ 1 Al2(SO4)x(OH)6-2x
102g 249g
80g×40.8%×(1-10%) x
解得x=71.7g
【思路点拨】本题以工艺流程形式考查了物质的性质,以及守恒法应用于化学计算,关键是利用铝元素守恒建立关系式。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
如图是锌、铜和稀硫酸形成的原电池,下列叙述不合理的是
A.溶液中H+向Zn电极移动
B.外电路中电流方向为:Cu→Zn
C.负极上的电极反应:Zn-2e-===Zn2+
D.有1 mol电子流过导线,则Cu电极上产生的H2为11.2 L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
A.加入合金的质量可能为9.6g
B.沉淀完全时消耗NaOH溶液体积为150mL
C.参加反应的硝酸的物质的量为0.4mol
D.溶解合金时产生NO气体体积0.224L(以标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是

A.原合金质量为 0.92 g B.产生氢气的体积为896 mL(标准状况下)
C.图中m的值为1.56 D.图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属的说法中,正确的是
①纯铁不容易生锈 ②钠着火用水扑灭 ③KSCN溶液可以检验Fe3+
④缺钙会引起骨质疏松,缺铁会引起贫血 ⑤青铜、不锈钢、硬铝都是合金
A.①③④ B.②③④⑤ C.①③④⑤ D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在800 K时,反应:CO(g)+H2O(g)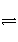
 H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
H2(g)+CO2(g),若初始浓度c0(CO)=2 mol·L-1,c0(H2O)=3 mol·L-1,则反应达到平衡时,CO转化成CO2的转化率为60%,如果将H2O的初始浓度加大为6 mol·L-1,试求此时CO转化为CO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构。下列说法正确的是( )
A.X、Y、Z、W的原子半径的大小关系为:W > Y > Z > X
B.在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是( )

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com