


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ƿ���ζ��ܡ���Һ©��ʹ��ǰ���������Ƿ�©ˮ |
| B����98%��Ũ��������100g10%��ϡ����ʱ����ʹ����Ͳ����õ�����ƿ |
| C�����Ũ����ʱ��ʹ�ô���������ɫ����ƿ |
| D��ȡ�û�ѧҩƷ��ʵ�飬ʣ��ҩƷ������ͬһ��Һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������ؼ����Ʊ�����������ˮ���ռ������������Ƴ����ܣ�����ƾ��� |
| B�����Թܼ���ʱ���ȸ��Թ����ؾ��ȼ��ȣ���̶��ֲ����� |
| C����ȼ��ȼ������(��H2,CO,CH4)ʱ���ȼ������崿�ȣ����ȼ |
| D���ڲⶨ��Һ��pHʱ����������ˮʪ���ò�����պȡ��Һ������ֽ�в��������ɫ���Ƚϡ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����pH��ֽ����������ˮ��pH |
B��ʵ��������ͼ��ʾװ���Ʊ�����ˮ |
| C�����ö����ЧӦ������۽����NaCl��Һ |
| D������Ͳ��ȡ20 mL 0.5000 mol��L-1H2SO4��Һ���ձ��У���ˮ80 mL�����Ƴ�0.1000 mol��L-1H2SO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A������ͼװ�õ�ϡ�����м��������ظ���ػ�����6%��H2O2��Һ������ʹ��������������ʱ��䳤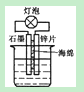 |
| B�����ᴿ��������NaCl��KNO3ʱ�����Ƚ�������ڽϸ��¶�������ˮ�γ�Ũ��Һ���پ�����ȴ�ᾧ�����ˡ�ϴ�ӡ�������KNO3���� |
| C����Ħ����ʱ�þƾ�ϴ�Ӳ�Ʒ���øɾ�����ֽ���ɣ������ư�˾ƥ�ִ�Ʒʱ����ˮϴ�Ӳ�Ʒ���ڿ����з�� |
| D��ֽ�������������ɷ�ʱ�������������̣�װ���������������������������չ����������������������ɫ��Ӧ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������ұ��������ͨ���û���Ӧ�õ������� |
| B�����õ��ķ������ԴӺ�ˮ�л�õ�ˮ |
| C����ˮ����Ĺ����в�����������ԭ��Ӧ |
| D���Ա��ǡ���ˮ������Ϊԭ����������þ�Ĺ����в��漰�û���Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
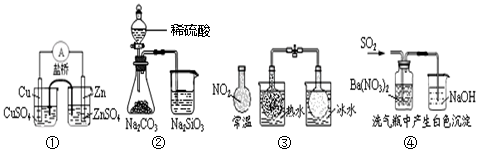
| A���������Zn��Cuԭ��� |
| B������֤���ǽ����ԣ�S��C��Si |
C����˵����Ӧ2NO2 N2O4��H��0 N2O4��H��0 |
| D���� ��ɫ����ΪBaSO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A����Ҫ��ʵ��ⶨ��������ͭ�����нᾧˮ����ĿҪ�õ�����������ǯ�� |
| B������Cu��OH��2���CuOҲ�ɵ�����ҺpH��Ӱ��ʵ������ |
| C��ϴ�Ӿ��壺���˳������©���м�����ˮ��û���壬��Ȼ���£��ظ�2-3�Σ� |
| D����18mol/LŨ���������ܽ�����4mol/L��ϡ���ᣬ��������һ��ֻ��3�֣� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com