
 |
 2C(g)
2C(g)科目:高中化学 来源:不详 题型:填空题
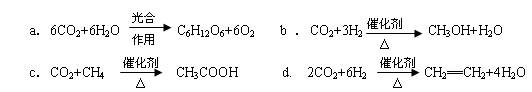
 CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
| A.升高温度 | B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离 | D.再充入1molCO2和3molH2 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
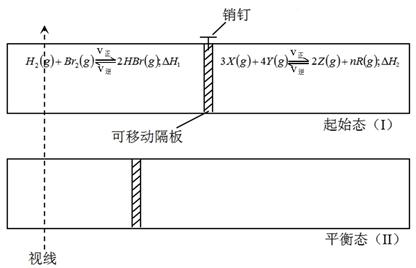
| 物 质 | H2 | Br2(g) | HBr | X | Y | Z | R |
| 物质的量(mol) | 2.0 | 2.0 | 5.0 | 设x | 8.0 | 0.50 | 1.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答: ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。
3A(g)+B(g) 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| I A | II A | III A | IV A | V A | VI A | VII A | ||
| 2 | ② | ③ | ④ | | ⑤ | ⑥ | | ||
| 3 | ⑦ | ⑧ | ⑨ | | ⑩ |  |  |
 的氢化物的还原性______稳定性 (填强或弱)
的氢化物的还原性______稳定性 (填强或弱) ,在周期表位于 。该
,在周期表位于 。该 与⑧形成化合物形成过程: 。
与⑧形成化合物形成过程: 。 的最高价氧化物对应水化物反应的离子方程式:
的最高价氧化物对应水化物反应的离子方程式: 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 HCO3-+OH-。下列说法中,正确的是( )
HCO3-+OH-。下列说法中,正确的是( )
A.升高温度,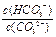 减小 减小 |
B.通入CO2,平衡向正反应方向移动 |
| C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大 |
| D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
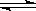 B(g) + 2C(g) ΔH=" m" kJ/mol,有下列两种图像。有关叙述正确的是
B(g) + 2C(g) ΔH=" m" kJ/mol,有下列两种图像。有关叙述正确的是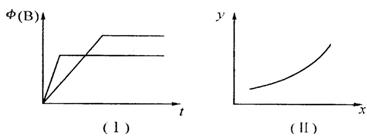
| A.若甲为恒容体系,图像(Ⅰ)代表温度不同时,时间与B的体积分数关系图,则m>0 |
| B.恒温条件下,图像(Ⅰ)可能代表压强不同时,时间与B的体积分数关系图 |
| C.恒温条件下,若乙容器存在图像(Ⅱ)关系,则当x代表压强时,y一定代表B的体积分数 |
| D.恒温条件下,若甲、乙两容器体积相同,起始时分别向甲中充人2 mol A,乙中充入1 molB,3 mol C,则达平衡后两容器中B的体积分数一定相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com