
【题目】短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物;元素C与元素D可形成D2C、D2C2两种化合物;元素B形成的化合物种类繁多且元素B与元素E处于同一主族;元素C与元素F处于同一主族。
(1)写出C的元素符号__________,D形成简单离子的结构示意图___________;
(2)写出元素A一种原子的中子数是质子数2倍的核素的符号____________;
(3)元素E在周期表中位置___________;
(4)比较E和F最高价氧化物对应水化物的酸性强弱______________(用化学式表示)
(5)写出A2C2电子式___________________;D与A形成化合物电子式_________________;元素A与B形成化合物A2B2的结构式________________;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨等特点,推测该晶体是_________晶体。
(7)写出C与D以原子个数比1∶1形成的化合物与水反应的化学方程式:_________________;若生成0.5 mol氧化产物,则转移的电子数目为__________(用NA表示);
(8)取8.3g仅由D和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,写出该化合物与过量盐酸反应的化学方程式_________________。
【答案】O ![]()
![]() 第三周期第ⅣA族 H2SiO3 < H2SO4
第三周期第ⅣA族 H2SiO3 < H2SO4 ![]() Na+[ H∶]- H—C≡C—H 原子 2Na2O2 +2H2O = 4NaOH+O2↑ NA Na3N+4HCl = 3NaCl+NH4Cl
Na+[ H∶]- H—C≡C—H 原子 2Na2O2 +2H2O = 4NaOH+O2↑ NA Na3N+4HCl = 3NaCl+NH4Cl
【解析】
短周期元素A、B、C、D、E和F的原子序数依次增大。元素A与元素C可形成A2C、A2C2两种化合物,则A为H元素,C为O元素;元素C与元素F处于同一主族,F为S元素;元素C与元素D可形成D2C、D2C2两种化合物,则D为Na元素;元素B形成的化合物种类繁多,B为C元素;元素B与元素E处于同一主族,E为Si元素,结合元素周期律和物质的性质分析解答。
根据上述分析,A为H元素,B为C元素,C为O元素,D为Na元素,E为Si元素,F为S元素。
(1) C为O元素;D为Na元素,钠是11号元素,最外层有1个电子,Na+离子的结构示意图为![]() ,故答案为:O;
,故答案为:O;![]() ;
;
(2)H的质子数=1,中子数=2,则质量数=1+2=3,该核素的符号为![]() ,故答案为:
,故答案为:![]() ;
;
(3) E为Si元素,硅是14号元素,在周期表中位于第三周期第ⅣA族,故答案为:第三周期第ⅣA族;
(4) 非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性Si<S,最高价氧化物对应水化物的酸性H2SiO3 < H2SO4,故答案为:H2SiO3 < H2SO4;
(5)A2C2为H2O2,是共价化合物,电子式为![]() ;D与A形成化合物为NaH,是离子化合物,电子式为Na+[ H∶]-;A2B2为C2H2,结构式为H—C≡C—H,故答案为:
;D与A形成化合物为NaH,是离子化合物,电子式为Na+[ H∶]-;A2B2为C2H2,结构式为H—C≡C—H,故答案为:![]() ;Na+[ H∶]-;H—C≡C—H;
;Na+[ H∶]-;H—C≡C—H;
(6)元素B与氮元素形成的化合物的晶体具有高熔点且耐磨,符合原子晶体的特点,故答案为:原子;
(7)C与D以原子个数比1∶1形成的化合物为Na2O2,Na2O2与水反应的化学方程式为2Na2O2 +2H2O = 4NaOH+O2↑;反应中Na2O2既是氧化剂又是还原剂,NaOH为还原产物,O2是氧化产物,生成0.5 mol氧化产物,转移1mol电子,数目为NA,故答案为:2Na2O2 +2H2O = 4NaOH+O2↑;NA;
(8)8.3g仅由Na和氮元素形成的某化合物与足量水充分反应后产生0.1mol氨气,则8.3g该化合物中含有0.1molN元素,质量为1.4g,则含有Na元素8.3g-1.4g=6.9g,物质的量为![]() =0.3mol,该化合物的化学式为Na3N,则Na3N与过量盐酸反应的化学方程式为Na3N+4HCl = 3NaCl+NH4Cl,故答案为:Na3N+4HCl = 3NaCl+NH4Cl。
=0.3mol,该化合物的化学式为Na3N,则Na3N与过量盐酸反应的化学方程式为Na3N+4HCl = 3NaCl+NH4Cl,故答案为:Na3N+4HCl = 3NaCl+NH4Cl。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:
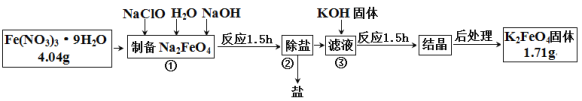
回答下列问题:
(1)步骤①中NaClO作______(填“氧化剂”“还原剂”或“催化剂”)。
(2)步骤②脱除的盐除NaNO3 外,还有 ____________(填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4 _____(填“>”或“<”)K2FeO4。
(4)本次实验中K2FeO4的产率为__________________。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,木条复燃;再向溶液中加入KSCN溶液,溶液变为血红色。如果标况下产生气体2.24L,则参加反应的FeO42- 数目_____________;K2FeO4作为净水剂的优点除铁无毒,能消毒杀菌外还有__________________________________。
(6)某同学设计以下两个实验探究高铁酸钾的稳定性。
(实验1)将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0mmolL-1(1mmolL-1=10-3molL-1)的试样,静置,结果见图1。
(实验2)将适量K2FeO4溶解于pH=4.74的水溶液中,配制成FeO42-浓度为1.0mmolL-1的试样,将试样分别置于 20℃、30℃、40℃和60℃的恒温水浴中,结果见图2。
(实验结论)根据图一,可以得出的结论是:________________________________________
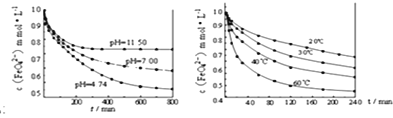
图1 图2
(7)常温下,某水溶液含有Fe3+,Cu2+,调节溶液pH=10时,两种氢氧化物沉淀共存,已知该温度下, Ksp(Fe(OH)3)= a, Ksp(Cu(OH)2)= b,则溶液中C(Fe3+)/C(Cu2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
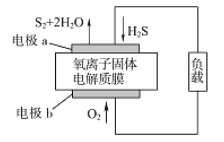
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中各微粒的浓度关系正确的是( )
A. pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液,c(NH4+)大小顺序为①=②>③
B. 0.2mol·L-1HCl与0.1 mol·L-1NaAlO2溶液等体积混合:c(Cl-)>c(Na+)>c(Al3+)>c(OH-)>c(H+)
C. 0.2 mol·L-1的Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
D. pH相等的NaF与CH3COOK溶液:[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①1 mol羟基所含电子数为10NA;
②一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液中含NH4+的物质的量小于0.5NA;
③1 mol臭氧和1.5 mol氧气含有相同的氧原子数;
④58.5 g的NaCl固体中含有NA个氯化钠分子;
⑤在反应KIO3+6HI==KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA;
⑥标准状况下,2.24 L H2O含有的分子数等于0.1NA;
⑦1 mol 乙烷分子中含有8NA个共价键;
⑧78gNa2O2中含有NA个阴离子;
⑨常温下,7.1 g Cl2与足量NaOH溶液反应转移的电子数约为0.2×6.02×1023;
⑩4.0 g重水(D2O)中所含质子数为2NA。
A. ④⑤⑦⑧⑨ B. ②③⑧⑩ C. 只有③ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列各种共价键的键能:C—H:a kJ· mol-1、O—H:b kJ· mol-1、O=O:c kJ·mol-1、C=O:d kJ·mol-1。写出甲烷气体完全燃烧生成CO2气体和气体水的热化学方程式:_________________________________
(2)火箭中的主要燃料是“肼(也称为联氨)”的液体物质。此化合物的相对分子质量为32。其中,含N的质量分数为87.5%,其余为H元素。则:
①肼的化学式为__________________,其结构式为_____________________________
②此燃料的氧化剂是N2O4气体,若燃烧0.2 mol肼液体放出的热量为 400 kJ,燃烧的产物对大气都无污染(生成的水为液态),则肼与N2O4气体反应的热化学方程式为:__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80 ℃时,将0.20 mol的N2O4气体充入1 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间 /(s) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) / mol · L-1 | 0.20 | c1 | 0.10 | c2 | c3 | c4 |
c(NO2) / mol · L-1 | 0.00 | 0.12 | 0.20 | 0.22 | 0.22 | 0.22 |
根据本题内容和表中提供数据填空(c1、c2、c3、c4表示相应的浓度),请回答下列各小题:
(1)该反应化学方程式_________________________; 表中c2____c3(填“<”、“>”或“=”)
(2)c4=_______mol · L-1,在0~20 s内NO2的平均反应速率为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A. SO2能杀菌、消毒,可用做食品防腐剂
B. NH4HCO3受热易分解,可用作氮肥
C. 明矾溶于水产生的硫酸根离子有氧化性,可用于净水
D. 常温下铁和浓硝酸不反应,可用铁质容器贮运浓硝酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com