
分析 根据铝与氢氧化钠和稀硫酸反应制氢氧化铝的方法分析,只有当铝全部转化为氢氧化铝时质量最大.通常有两种方法制取,一种是铝与硫酸反应生成了硫酸铝,硫酸铝与氢氧化钠反应制取氢氧化铝;另一种是铝与氢氧化钠反应生成了偏铝酸钠,偏铝酸钠与不足量的硫酸反应生成了氢氧化铝,据此分析回答.
解答 解:20g16%的氢氧化钠溶液中溶质的物质的量为:$\frac{20g×16%}{40g/mol}$=0.08mol,2Al+2H2O+2NaOH=2NaAlO2+3H2↑,所以生成0.08molNaAlO2,20mL 2mol/L的硫酸的物质的量为:20×2×0.001=0.04mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑,所以生成铝离子的物质的量为:$\frac{0.04mol×2}{3}$=0.0267mol,因为:3AlO2-+Al3++6H2O=4Al(OH)3↓,而铝离子完全反应只需偏铝酸根离子0.0799mol,所以铝离子完全反应,生成氢氧化铝的物质的量为4×$\frac{0.04mol×2}{3}$=0.1mol,
答:理论上最多可生成0.1mol氢氧化铝.
点评 本题主要考查了铝的性质、根据化学方程式的计算,难度不大,注意铝既能与硫酸反应又能与氢氧化钠反应.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和溶液AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
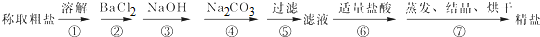
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
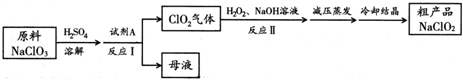
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体和浊液这三种分散系的根本区别是分散质粒子直径的大小 | |
| B. | 硅单质广泛用于光纤通讯 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一支钢笔使用不同品牌墨水时,容易发生堵塞现象 | |
| B. | 当日光从窗隙射入暗室时,可观察到一束光线 | |
| C. | 向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深 | |
| D. | 向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在人体内水解产物只有葡萄糖 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 淀粉和纤维素水解最终产物都是葡萄糖 | |
| D. | 鉴别部分蛋白质可利用浓硫酸与蛋白质的颜色反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com