
分析 硫酸与氢氧化钡反应生成硫酸钡和水,反应的实质为,钡离子与氢氧根离子与氢离子,成水,钡离子与硫酸根离子生成硫酸钡沉淀,离子方程式不能写成H++OH-+SO42-+Ba2+═BaSO4↓+H2 0,因为1个钡离子对应2个氢氧根离子,离子个数配比不符合物质结构,据此解答.
解答 解:硫酸与氢氧化钡反应生成硫酸钡和水,反应的实质为,钡离子与氢氧根离子与氢离子,成水,钡离子与硫酸根离子生成硫酸钡沉淀,离子方程式不能写成H++OH-+SO42-+Ba2+═BaSO4↓+H2 0,因为1个钡离子对应2个氢氧根离子,离子个数配比不符合物质结构,正确的离子方程式应为:Ba2++2H++20H-+SO42-=BaSO4↓+2H2O,
故答案为:Ba2++2H++20H-+SO42-=BaSO4↓+2H2O.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意书写离子方程式时,离子个数配比应符合物质结构,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32- NO3- SO42- I- |
| A. | 由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、NH4+、Cu2+ | |
| B. | Ⅲ中加入盐酸生成无色气体的离子方程式是6I-+2NO3-+8H+═3I2+2NO↑+4H2O | |
| C. | 原溶液一定只含有的离子I-、NO3-、SO42-、Mg2+、Al3+ | |
| D. | 另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧沉淀至恒重,得到的固体质量为0.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
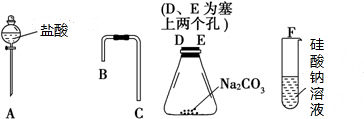
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
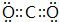 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com