
| A. |  闻气体的气味 | B. | 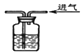 用浓硫酸干燥CO2 | ||
| C. | 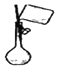 向容量瓶中转移液体 | D. | 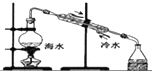 用海水提取淡水 |
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:推断题
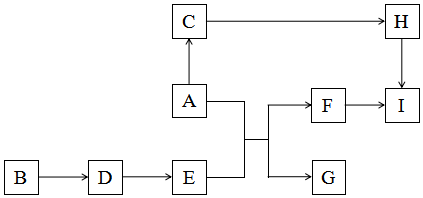
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L 1mol/L 1mol/L | B. | 1mol/L 4mol/L 9mol/L | ||
| C. | 1mol/L 2mol/L 3mol/L | D. | 体积未知,无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 78gNa2O2固体与62gNa2O固体中阴、阳离子总数均为3NA | |
| B. | 在2H2O+2Na2O2=4NaOH+O2↑的反应中,当产生标况下5.6LO2时,转移的电子数为NA | |
| C. | 1mol SiO2分子中含NA个Si原子和2NA个氧原子 | |
| D. | 54g铝与足量的稀硝酸反应产生的氢气分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用增大臭氧浓度来改善空气质量 | |
| B. | 利用地热、潮汐等能源替代化石燃料 | |
| C. | 使用可降解塑料减少“白色污染” | |
| D. | 选用不含氮、磷的洗涤剂防止蓝藻污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )
现代建筑的门窗架常用电解加工成的古铜色硬铝制造.取硬铝样品进行如下实验(每一步试剂均过量),由此可以推知硬铝的组成可能为( )| A. | Al、Mg、SiO2、Zn | B. | Al、Fe、Zn、Na | C. | Al、Na、Cu、Fe | D. | Al、Cu、Mg、Si |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
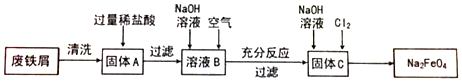
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com