
| y |
| 4 |
| y |
| 2 |
| y |
| 4 |
| y |
| 2 |
| xmol×1+ymol×2 |
| xmol+ymol |
| 2 |
| 3+2 |
| 2 |
| 2+3 |


科目:高中化学 来源: 题型:
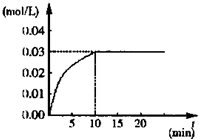 在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:
在某一容积为5L的密闭容器内,加入3mol的CO和0.3mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由同种元素组成的物质肯定属于纯净物 |
| B、具有相同质子数的微粒都属于同种元素 |
| C、一种元素可有多种离子,但只有一种电中性的原子 |
| D、含有离子键的化合物一定是离子化合物. |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 向某气体通入品红溶液,品红溶液褪色 | 该气体一定是SO2 |
| D | 将少量某物质的溶液滴加到硝酸银溶液中,有白色沉淀生成 | 该溶液中一定含有Cl- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com