
下表中有关离子方程式的评价合理的是( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣ |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O == H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:单选题
下列各组离子在溶液能大量共存,加入Fe2(SO4)3后仍能大量共存的是
| A.Ca2+、I-、CO32-、ClO- | B.Fe2+、H+、K+、NO3- |
| C.Ba2+、Na+、SCN-、Cl- | D.Cu2+、K+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列实验现象及相关的离子方程式均正确的是( )
| A.碳酸钙粉末中加入醋酸溶液,固体质量减小,生成无色气体 CaCO3 + 2H+=Ca2+ + CO2↑ + H2O |
| B.向BaCl2溶液中通入SO2气体,出现白色沉淀:Ba2+ + SO2 + H2O = BaSO3↓ + 2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色 2MnO4- + 7H2O2 + 6H+ = 2Mn2+ + 6O2↑ + 10H2O |
| D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合,生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,下列各组离子、分子在指定溶液中一定能大量共存的是
| A.Na2S溶液中 SO42-、 K+、Br-、Cu2+ |
| B.在c(H+)=1.0×10-13mol·L-1的溶液中 Na+、S2-、AlO2-、SO32- |
| C.能使甲基橙显红色的溶液: K+、MnO4-、H2C2O4、SO42- |
| D.在 NH3·H2O 的溶液中Ba2+、NO3-、Cl-、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列离子方程式表达正确的是
| A.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| B.向Fe(OH)2中加入足量的稀HNO3:Fe(OH)2+2H+=Fe2++2H2O |
| C.向碳酸氢铵溶液中加入足量的氢氧化钠溶液:NH4++OH-=NH3·H2O |
| D.向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某无色溶液中含有:①Na+ ②Ba2+ ③Cl- ④Br- ⑤SO⑥SO中的一种或几种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下表,下列结论正确的是
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
| (3) | 向(2)所得的溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
| (4) | 将(3)中的溶液过滤,向滤液中加入AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的 SiO2、Fe2O3杂质)生产铵明矾晶体
NH4Al(SO4)2?12H2O,其工艺流程图如下: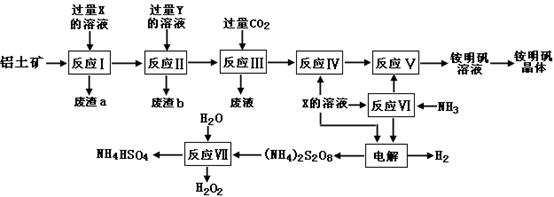
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:________________________ ____。
(5)反应Ⅶ的化学方程式为:_________________________ _____________;
NH4HSO4溶液中离子浓度由大到小顺序为:__________________________ _。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是 (填选项字母)
| A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2 (SO4)3+2Al(OH)3↓ |
| B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
| C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
| D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下列叙述I和II均正确并有因果关系的是
| 选项 | 叙述I | 叙述II |
| A | KNO3的溶解度大 | 用重结晶法除去KNO3中混有的NaCl |
| B | BaSO4难溶于酸 | 用盐酸和BaCl2溶液检验SO42- |
| C | NH3能使酚酞溶液变红 | NH3可用于设计喷泉实验 |
| D | Ca(OH)2能制成澄清石灰水 | 可配制2.0 mol?L-1的Ca(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
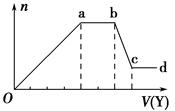
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com