
| A、检测时,电解质溶液中的H+向负极移动 |
| B、电池反应的化学方程式为CH3CH2OH+O2═CH3COOH+H2O |
| C、正极上发生的反应为:O2+4e-+2H2O═4OH- |
| D、若有0.4 mol电子转移,则在标准状况下消耗4.48 L氧气 |


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、同周期元素,从左到右电负性依次增大 |
| B、主族元素的最高化合价都等于最外层电子数(O、F除外) |
| C、同主族元素,从上到下,原子半径依次增大 |
| D、金属元素的正化合价越高,其对应的氢氧化物的碱性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的溶液 |
| B、pH=2的CH3COOH和pH=12的NaOH溶液等体积混合 |
| C、CH3COONa溶液 |
| D、c(NH+4)=c(Cl-)的NH4Cl和氨水的混合溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
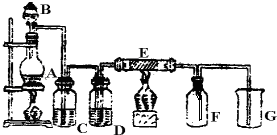 (Ⅰ)在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.
(Ⅰ)在下面的装置中,A是Cl2发生装置,C、D为气体的净化装置,E是硬质玻璃管中装有细铁丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

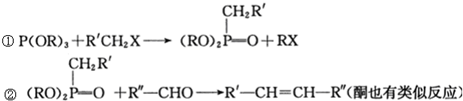
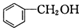 和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成
和P(OC2H5)3为原料,选择适当的无机试剂和催化剂,通过合理的途径合成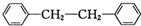 .请补全下列合成路线(含条件、试剂和主要产物的结构简式).
.请补全下列合成路线(含条件、试剂和主要产物的结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体和非晶体的区别,就是晶体有自范性,而非晶体没有 |
| B、常温下为气体或者液体的物质,固体时都是分子晶体 |
| C、原子晶体一定是单质元素的原子组成的 |
| D、金属晶体的熔沸点总比分子晶体的熔沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com