
| A. | 水在化学反应中既可做氧化剂又可做还原剂 | |
| B. | 14C和14N质量数相同,化学性质也相同 | |
| C. | 牛奶是一种胶体,能发生丁达尔现象 | |
| D. | “水滴石穿”是因为CaCO3与CO2、水发生了化学反应 |
分析 A.元素化合价升高失电子做还原剂,元素化合价降低得到电子做氧化剂;
B.14C和14N质量数相同,质子数不同,最外层电子数不同,化学性质不相同;
C.胶体具有丁达尔现象;
D.碳酸钙与二氧化碳的水溶液反应生成可溶性的碳酸氢钙.
解答 解:A.水和钠反应表现氧化性,水和氟单质反应表现还原性,水在化学反应中既可做氧化剂又可做还原剂,故A正确;
B.14C和14N质量数相同,质子数不同,最外层电子数不同,化学性质不相同,故B错误;
C.牛奶是一种胶体分散系,能发生丁达尔现象,故C正确;
D.碳酸钙与二氧化碳的水溶液反应生成可溶性的碳酸氢钙,所以溶解了CO2的雨水能把石头穿透,发生了化学反应,故D正确;
故选B.
点评 本题考查了原子结构、原子性质、胶体性质等知识点,掌握基础是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
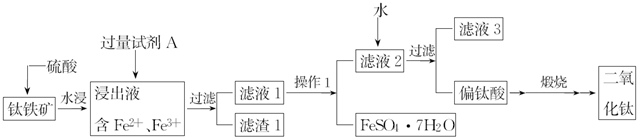
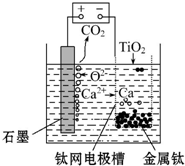
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟盐酸的反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铵固体和熟石灰共热:NH4++OH═-NH3↑+H2O | |
| C. | 向碳酸钙中加入盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 氯化铁溶液和氢氧化钠溶液的反应:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液可大量存在:H+、Cl-、MnO4- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中可能存在:K+、Na+、[Al(OH)4]-、CO32- | |
| C. | 与Al反应能放出H2的溶液中可大量存在:Fe2+、K+、NO3-、SO42- | |
| D. | 氢氧化钙溶液中可大量存在:Na+、ClO-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,还可以写成
,还可以写成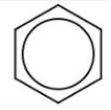 ,1mol苯可以跟3molH2发生加成反应生成环己烷,环己烷的结构简式为
,1mol苯可以跟3molH2发生加成反应生成环己烷,环己烷的结构简式为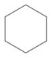 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
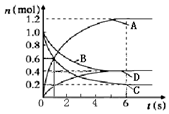 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应推断合理的是( )| A. | 该反应的化学方程式为3B+4C=6A+2D | |
| B. | 反应进行到1s时,3v(A)=v(D) | |
| C. | 反应进行到6s时,各物质的质量分数不变 | |
| D. | 反应进行到6s时,B的平均反应速率为0.1mol/(L•s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com