
下列实验操作能达到预期实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管, 加入几滴0.1 mol/L KMnO4溶液 |
B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
C | 使蛋白质能变性 | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液,产生沉淀 |
D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
对于常温下PH=10的氨水,下列说法正确的是
A.该溶液与PH=10的 Ba(OH)2溶液,溶质的物质的量浓度之比为2:1
B.该溶液由水电离出来的c(H+)与PH=4的NH4Cl溶液相同
C.降低温度,溶液的c(NH4+)/ c(NH3·H3O)减小,PH降低
D.往该溶液中加入足量的NH4Cl固体后,c(NH4+) + c(NH3·H3O)= c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省郑州市高三第二次质量预测理综化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术](15分)利用生产磷铵[(NH4)3P04]排放的废渣磷灰石[(Ca3(P04)2)]制取硫酸并联产水泥的工艺流程如下:
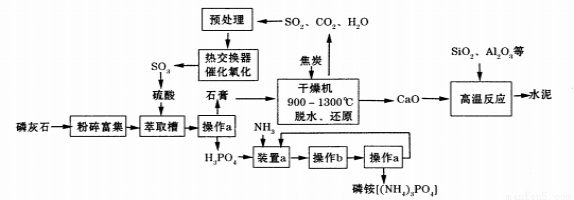
(1)操作a的名称 ,实验室中进行此操作时用到的玻璃仪器有 。
(2)在实验室中操作b包括____、冷却结晶。
(3)干燥机中发生反应的化学方程式为 。
(4)水泥常用做建筑材料,是利用了水泥的 性质。
(5)SO2的催化氧化反应为2SO2(g)十02(g)  2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
2S03(g)。实验测得压强及温度对S02转化率的影响如下表(原料气各成分的体积分数为SO2:7%、02:11%、N2:82%)。
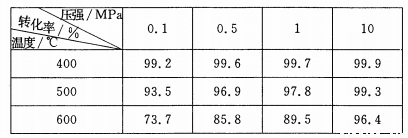
①实际生产中,S02的催化氧化反应是在常压、400 ℃ —500 ℃ 条件下进行。采用常压的主要原因是 ;该反应化学平衡常数大小关系是:K(400 ℃ ) K(500 ℃)(填“>”、“<”或“=” )。
②催化氧化时使用热交换器的原因是 。
(6)制硫酸所产生的尾气除了含有N2、02外,还含有SO2、微量的S03和酸雾。下列能用于测定硫酸尾气中SO2含量的试剂组是 。(填写相应字母)
a、NaOH溶液、酚酞试液 b、Na2C03溶液、酚酞试液
c、碘水、淀粉溶液 d、KMn04溶液、稀硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市延庆县高三3月模拟理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.油脂的氢化是指将不饱和程度较高、熔点较低的液态油,通过催化加氢,可提高饱和度,转化成半固态的脂肪的过程
B.在酸性条件下,蔗糖水解成葡萄糖和果糖,它们都能被溴水氧化
C.氨基酸是两性化合物,只有两个不同氨基酸分子间脱水才能形成肽键
D.蛋白质遇到醋酸铅变性沉淀,加入大量的水,沉淀还可溶解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:填空题
(12分)为应对环境污染,使得对如何减少煤燃烧和汽车尾气中各种含碳、氮、硫等气体的排放,及有效地开发利用碳资源的研究显得更加紧迫。
(1)为减少煤燃烧中废气的排放,常将煤转化为清洁气体燃料。请写出焦炭与水蒸气高温下反应的化学方程式: 。
(2)选择适当的催化剂在高温下可将汽车尾气中的 CO、NO转化为无毒气体。
已知:①2CO(g)+O2(g)=2CO2(g) H1=-566 kJmol-1
②2NO(g)+2CO(g) N2(g)+ 2CO2(g) H2=-746 kJmol-1
则反应N2(g)+ O2(g)= 2NO(g)的H= kJmol-1。
(3)在一定温度下,向1L密闭容器中充入0.5 mol NO、2 mol CO,发生上述反应②,
20s反应达平衡,此时CO的物质的量为1.6 mol。在该温度下反应的平衡常数K= 。
(4)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用以CO2和H2O为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应式为_____________________。
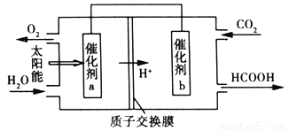
(5)氮氧化物进入水体可转化为NO3─,电化学降解法可用于治理水中NO3─的污染。原理如图所示。

电源正极为 (填“A”或“B”),若电解过程中转移了0.4mol电子,则处理掉的NO3─为 g。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
(12分)废旧显示屏玻璃中含SiO2、Fe2O3、CeO2、FeO等物质。某课题小组以此玻璃粉末为原料,制得Ce(OH)4和硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O],流程设计如下:

已知:Ⅰ.酸性条件下,铈在水溶液中有Ce3+、Ce4+两种主要存在形式,Ce4+有较强氧化性;
Ⅱ.CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答以下问题:
(1)反应①的离子方程式是 。
(2)反应②中H2O2的作用是 。
(3)反应③的离子方程式是 。
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:
2Ce3+ (水层)+ 6HT(有机层) 2CeT3 (有机层)+ 6H+(水层)
2CeT3 (有机层)+ 6H+(水层)
从平衡角度解释:向CeT3 (有机层)加入H2SO4 获得较纯的含Ce3+的水溶液的原因是 。
(5)硫酸铁铵矾[Fe2(SO4) 3·(NH4) 2SO4·24H2O]广泛用于水的净化处理,其净水原理用离子方程式解释是 。
(6)相同物质的量浓度的以下三种溶液中,NH4+的浓度由大到小的顺序是 。
a.Fe2(SO4) 3·(NH4) 2SO4·24H2O
b.(NH4) 2SO4
c.(NH4) 2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省洛阳市高三第二次统一考试理综化学试卷(解析版) 题型:填空题
(15分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气作为能源最大的优点是燃烧产物是水,无污染。请你再列举一条氢气作为能源的优点:_____________________________________________。
(2)LiAlH4是一种重要的储氢载体,能与水反应得到LiAlO2和氢气,该反应消耗1mol LiAlH4时转移的电子数目为_______________________________________。
(3)氮化锂(Li3N)是非常有前途的储氢材料,其在氢气中加热时可得到氨基锂(LiNH2),其反应的化学方程式为;Li3N+2H2 LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
LiNH2+2LiH,氧化产物为___________(填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的___________%(精确到0.1)。
(4)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:

在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=__________。
(5)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其他有机物)。

①导线中电子移动方向为__________。(用A、D表示)
②生成目标产物的电极反应式为_______________________________。
③该储氢装置的电流效率η=_________________。
(η= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省高一4月月考理科化学试卷(解析版) 题型:选择题
下列说法中不正确的是
A.H2O的沸点比较高,是由于水分子间存在氢键的原因
B.除稀有气体外的非金属元素都能生成不同价态的含氧酸
C.若ⅡA族某元素的原子序数为m,则同周期ⅢA族元素的原子序数可能为m+11
D.由于分子间作用力比化学键弱得多,所以干冰升华容易,而CO2气体分解却不易
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com