
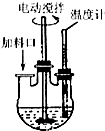
 实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.
实验室制取高纯NaI晶体(无色)可按下列步骤进行:按化学计量称取各原料,在三颈烧瓶中(如图)先加入适量的高纯水,然后按Na2CO3、I2和水合肼的投料顺序分批加入.分析 (1)加快反应速率的外因:温度、浓度,固体的表面积和催化剂等,据此回答;
(2)碘单质受热易升华,据此回答;
(3)NaIO在水溶液中可以和肼发生氧化还原反应,据此书写方程式;
(4)搅拌器的搅拌作用可以使混合物均匀混合,将产生的气体及时的排出;
(5)I2与Na2CO3溶液反应需要一定的环境,注意控制反应物的加入顺序;
(6)制得高纯NaI晶体,首先进行除杂,最后进行蒸发结晶洗涤干燥操作来分离和提纯物质即可.
解答 解:(1)a.将碘块研成粉末,增加接触面积,可以加快反应速率,故正确;
b.起始时加少量NaI,可以起到催化剂的作用,加快反应速率,故正确;
c.将溶液适当加热可以加快反应速率,故正确;
d.加大高纯水的用量,降低浓度会降低反应速率,故错误,
故选abc;
(2)I2与Na2CO3溶液反应适宜温度为40~70℃,温度不宜超过70℃,这样可以防止碘单质受热易升华,故答案为:防止碘升华;
(3)NaIO在水溶液中可以和肼发生氧化还原反应生成NaI、氮气和水,即2IO-+N2H4+H2O=2I-+N2+3H2O,故答案为:2IO-+N2H4+H2O=2I-+N2+3H2O;
(4)结合搅拌器的搅拌作用,整个实验过程中都需要开动搅拌器,其目的是可以使混合物均匀混合,将产生的气体及时的排出,故答案为:使得合成反应均匀进行,并使产生的二氧化碳、氮气等气体及时排除;
(5)根据反应:I2+Na2CO3═NaI+NaIO+CO2↑;△H<0,3I2+3Na2CO3═5NaI+NaIO3+3CO2↑;△H<0,后期I2与Na2CO3溶液反应难以进行,碘单质的浓度减小导致的,此阶段可以先加入碘、水合肼,最后加入碳酸钠,故答案为:先加入碘、水合肼,最后加入碳酸钠;
(6)所得溶液含少量SO42-,极少量的K+和Cl-,首先除杂,依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,然后,调整溶液的酸碱性,进行蒸发结晶操作,进行物质的分离和提纯,即趁热过滤将滤液在不断搅拌下依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,滤液中在不断搅拌下加入HI溶液至使用pH试纸测定溶液的pH大约为6,蒸发冷却结晶,再次过滤,用高纯度的水洗涤晶体2-3次,在真空干燥箱中干燥,
故答案为:趁热过滤将滤液在不断搅拌下依次加入稍过量的氢氧化钡、碳酸钠溶液,过滤,滤液中在不断搅拌下加入HI溶液至使用pH试纸测定溶液的pH大约为6,蒸发冷却结晶,再次过滤,用高纯度的水洗涤晶体2-3次,在真空干燥箱中干燥.
点评 本题综合考查学生物质的分离和提纯等化学实验方案设计知识,注意知识的迁移应用是关键,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试管A | 试管B | |
| 加入试剂 | ||
| 实验现象(褪色时间) | ||
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池中阴离子向正极移动 | |
| B. | 原电池是将电能转化为化学能的装置 | |
| C. | 原电池中电子流出的极为负极,发生氧化反应 | |
| D. | 原电池正极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com