
| 滴定次数 | 待测氨水溶液的体积/mL | 0.10mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
分析 (1)强酸与弱碱反应生成强酸弱碱盐,强酸弱碱盐水解显酸性,应选择甲基橙做指示剂;溶液颜色由由黄变橙色达到终点;
(2)先分析所耗盐酸标准液的体积的有效性,然后求出所耗盐酸标准液的体积平均值,然后根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测}$计算;
(3)分析操作对标准液体积的影响,依据c(待测)=$\frac{c(标准)×V(标准)}{V(待测}$进行误差分析;
(4)根据酸碱滴定中,无论溶液中的溶质是氯化铵、氯化铵和氯化氢、氯化铵和一水合氨,该溶液一定不显电性,则利用遵循电荷守恒来分析解答;
(5)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(OH{\;}^{-}).c(N{H}_{4}{\;}^{+})}{c(N{H}_{3}.{H}_{2}O)}$.
解答 解:(1)强酸与弱碱反应生成强酸弱碱盐,强酸弱碱盐水解显酸性,应选择甲基橙做指示剂;溶液颜色由由黄变橙色达到终点;
故答案为:甲基橙;甲基橙;
(2)依据图中数据可知第二组数据误差较大舍弃,则消耗的标注液体积为:$\frac{26.11+26.09}{2}$=26.10mL;则c(待测)=$\frac{c(标准)×V(标准)}{V(待测}$=$\frac{0.10mol/L×26.10mL}{25.00mL}$=0.1044 mol/L;
故答案为:0.1044 mol/L.
(3)A.观察酸式滴定管液面时,开始仰视,滴定终点平视,导致消耗的标准液体积偏小,则滴定结果偏低;
故答案为:偏低;
B.若将锥形瓶用待测液润洗,然后再加入25.00mL待测液,导致消耗的标注液体积偏大,则滴定结果偏高;
故答案为:偏高;
C.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失,导致消耗的标准液体积偏大,则滴定结果偏高;
故答案为:偏高;
D.锥形瓶内溶液颜色出现变色,立即记下滴定管内液面所在刻度,导致过早的判断滴定终点,消耗标准液体积偏小,则滴定结果偏低;
故答案为:偏低;
(4)A、若滴定后溶液中的溶质为氯化铵和一水合氨,则一般溶液显碱性,即c(OH-)>c(H+),溶液中弱电解质的电离>盐的水解,即c(NH4+)>c(Cl-),则符合电荷守恒,故A是可能出现的结果,故A选;
B、若滴定后溶液中的溶质为氯化铵和一水合氨,当溶液中弱电解质的电离程度与盐的水解程度相同时,溶液为中性,则c(OH-)=c(H+),由电荷守恒可知c(NH4+)=c(Cl-),故B是可能出现的结果,故B选;
C、当c(Cl-)>c(NH4+),c(OH-)>c(H+),则溶液中阴离子带的电荷总数就大于阳离子带的电荷总数,显然与电荷守恒矛盾,故C是不可能出现的结果,故C不选;
D、若滴定后溶液中的溶质为氯化铵,由铵根离子水解则溶液显酸性,即c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+),且符合电荷守恒,故D是可能出现的结果,故D选;
故选:A B D;
(5)解:在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3.H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(OH{\;}^{-}).c(N{H}_{4}{\;}^{+})}{c(N{H}_{3}.{H}_{2}O)}$=$\frac{1{0}^{-7}×5×10{\;}^{-2}}{0.5a-5×10{\;}^{-2}}$=$\frac{1{0}^{-8}}{a-0.1}$;
故答案为:中性;$\frac{1{0}^{-8}}{a-0.1}$.
点评 本题考查酸碱滴定,离子浓度大小比较,弱电解质电离平衡常数的计算,明确溶中和滴定的原理,熟悉溶液中的弱电解质的电离及盐的水解是解题关键,注意溶液中电荷守恒规律的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 定容时俯视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
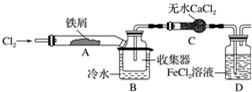 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com