
【题目】(1)质量相同的O2、NH3、H2、Cl2四种气体中,在相同温度和相同压强条件下,体积最大的是 。
(2)下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是 。(填序号)
①NaAlO2②Ca(OH)2③Na2CO3④Al(OH)3⑤NaHCO3⑥Si
(3)氯水中含有多种成分。将紫色石蕊试液滴入氯水中,溶液显红色起作用的成分是 ;过一会儿,溶液颜色逐渐褪去,起作用的成分是 ;
(4)已知:Fe2+的还原性强于Br—,标准状况下把11.2L氯气通入500ml 0.8mol/L FeBr2溶液中,写出反应完全后的离子方程式 。
【答案】(1) H2; (2)④⑤;(3)HCl或H+;HClO;(4)5Cl2+4Fe2++6Br=10Cl—+4Fe3++3Br2
【解析】试题分析:(1)根据阿伏加德罗推论,相同温度和相同压强下,体积比等于物质的量之比,n=![]() ,相同质量、相同温度、相同压强条件下,体积之比等于摩尔质量的反比,H2摩尔质量最小,体积最大;(2)既能与盐酸反应,又能氢氧化钠反应的有:Al、Al2O3、Al(OH)3、NaHCO3、NH4HCO3、(MH4)2CO3、NH4HS、(NH4)2S、(NH4)2SO3、NH4HSO3等,④⑤符合题意;(3)氯水的成分:Cl2、HCl、HClO,石蕊遇酸变红,HClO弱酸不能使石蕊变红,因此溶液显红色起作用的成分是HCl或H+;HClO具有强氧化性,能把有色物质氧化成无色物质,因此溶液颜色褪去,起作用的成分是HClO;(4)Fe2+的还原性Br-,Cl2先于Fe2+反应:2Fe2++Cl2=2Fe3++2Cl-,过量Cl2再与Br-反应:Cl2+2Br-=2Cl-+Br2,0.5molCl2、n(Fe2+)=0.4mol、n(Br-)=0.8mol,Fe2+全部参加反应,Br-部分参加反应,根据参加反应的物质的量之间的关系,离子方程式:5Cl2+4Fe2++6Br=10Cl—+4Fe3++3Br2。
,相同质量、相同温度、相同压强条件下,体积之比等于摩尔质量的反比,H2摩尔质量最小,体积最大;(2)既能与盐酸反应,又能氢氧化钠反应的有:Al、Al2O3、Al(OH)3、NaHCO3、NH4HCO3、(MH4)2CO3、NH4HS、(NH4)2S、(NH4)2SO3、NH4HSO3等,④⑤符合题意;(3)氯水的成分:Cl2、HCl、HClO,石蕊遇酸变红,HClO弱酸不能使石蕊变红,因此溶液显红色起作用的成分是HCl或H+;HClO具有强氧化性,能把有色物质氧化成无色物质,因此溶液颜色褪去,起作用的成分是HClO;(4)Fe2+的还原性Br-,Cl2先于Fe2+反应:2Fe2++Cl2=2Fe3++2Cl-,过量Cl2再与Br-反应:Cl2+2Br-=2Cl-+Br2,0.5molCl2、n(Fe2+)=0.4mol、n(Br-)=0.8mol,Fe2+全部参加反应,Br-部分参加反应,根据参加反应的物质的量之间的关系,离子方程式:5Cl2+4Fe2++6Br=10Cl—+4Fe3++3Br2。


科目:高中化学 来源: 题型:
【题目】某工厂排放的废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. Ag+、K+、NO3-、HCO3- B. Ag+、NH4+、Mg2+、HCO3-
C. K+、NH4+、NO3-、SO42- D. K+、Mg2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ICl3遇水会产生大量的腐蚀性白色浓雾,有强烈的催泪性.若两种生成物之一是HCl,则另一种是( )
A.HIO3
B.HIO2
C.HIO
D.ICl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M元素,它们在周期表中位罝如图所示,下列说法不正确的是
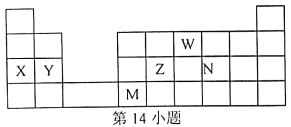
A. 离子半径:W>X>Y B. 单质的还原性:X>Y>N
C. 硒与元素N同主族,最高价氧化物的水化物的酸性比N的弱 D. 元素M位于金属与非金属的分界线附近,推测M元素的单质一定可以做半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究,为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品。

(1)锥形瓶A内所盛试剂是________溶液;装置B的作用是________________;
锥形瓶D内发生反应的离子方程式为__________________________________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为________________;
操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法_________________________;
该黄铜矿中硫元素的质量分数为________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是________。
A.KSCN溶液、氯水
B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+,设计实验方案验证泡铜中是否含有Cu2O?
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是一种无色、苦杏仁味的液体,是一种温和的氧化剂,可用于制造苯胺、绝缘物质和光泽剂等。已知:
物质 | 密度/g·cm-3 | 沸点/℃ | 水中溶解度 |
硝基苯 | 1.205 | 210.9 | 难溶 |
苯 | 0.879 | 80.0 | 难溶 |
实验室制备硝基苯的过程如下:
步骤一:配制混酸。将20.0 mL浓硫酸和14.6 mL浓硝酸混合均匀。
步骤二:仪器组装。按照下图,在250 mL的三口烧瓶中加入配制好的混酸,三口烧瓶上配一支c仪器,左口装一支0~100℃的温度计,控制反应温度50~60℃,右口装上一支b仪器,在b仪器中加入17.8 mL的苯,将三口烧瓶放在水浴中。
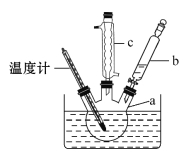
步骤三:水油分液。反应结束后,将三口烧瓶移出水浴,待反应液冷却后,将其倒入分液漏斗,静置、分层、分液。
步骤四:产物除杂。此时所得的硝基苯略显黄色,需进行除杂处理。先用等体积的冷水洗涤,再用10%的Na2CO3溶液多次洗涤,直至洗涤液不显酸性,最后用蒸馏水洗涤至中性,将粗硝基苯从分液漏斗中转移到锥形瓶中,加入无水CaCl2,震荡、过滤,将产物转移到干燥的锥形瓶中。对产物进行蒸馏操作,蒸出硝基苯混有的苯,得纯净的硝基苯。
步骤五:余酸滴定。将所得的酸液稀释到250 mL,取25 mL用0.1 mol·L-1的NaOH溶液进行滴定,记录消耗碱液的体积为V1mL,再取25 mL待测酸液,再次滴定,消耗标准NaOH溶液V2mL。
请回答下列问题:
(1)配制浓硫酸和浓硝酸的混酸的步骤是________________________________。
(2)三口烧瓶上口的仪器名称为________,右口的仪器名称为________。
(3)硝基苯和溶液层的分离过程,硝基苯应该从分液漏斗的________放出。
(4)除杂过程第一次水洗和Na2CO3溶液洗涤的目的是_____________________,
第二次水洗的目的是________________________________________________。
(5)无水CaCl2用途是________________________________________________。
(6)蒸馏操作加入碎瓷片目的是________________________________________,
冷却水应该________口进水________口出水,温度计水银球位置应在_______。
(7)通过滴定剩余酸的量可以大体推断,反应物的消耗量和产物的产率。滴定过程选择________作为指示剂,滴定终点的现象为_________________________,
若在滴定起点正常读数,滴定终点俯视读数会导致所测定酸的浓度________(填“偏大”“偏小”“不变”),根据实验数据计算,稀释后酸液中H+浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y和Z均为短周期主族元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Y元素的名称为________。Z的离子结构示意图为_________。
元素Y的简单离子和元素Z的简单离子,半径较大的是________(写出离子符号)。
(2)X和Y组成的化合物中,既含极性共价键又含非极性共价键的是______(写化学式),该物质核外电子总数为______。
(3)化合物Z2Y2的电子式为___________。
(4)X的单质与Y的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极电极反应式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温,下列溶液中各浓度关系不正确的是
A. 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液pH>7,则一定有:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 1L0.1molL-1CuSO4·(NH4)2SO46H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C. 0.1molL-1NaHCO3溶液中:c(Na+)+c(H+)+c(H2CO3)≠c(HCO3-)+c(CO32-)+c(OH-)
D. 物质的量浓度分别为c1和c2的两种醋酸溶液,若其pH分别为a和a+1,则c1>10c2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目拾遗》中在药物名“鼻冲水”条目下写到:贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减.气甚辛烈,触人脑,非有病不可嗅;在“刀创水”条目下写到:治金创,以此水涂伤口,即敛合如故.这里所说的“鼻冲水”、“刀创水”分别指的是( )
A.氢氟酸、食盐水
B.氨水、碘酒
C.石灰水、硝酸
D.稀硫酸、食醋
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com