
下列判断正确的是( )
|
| A. | 根据同周期元素的第一电离能变化趋势,推出P的第一电离能比S大 |
|
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正化合价都是+7 |
|
| C. | 晶体中一定存在化学键 |
|
| D. | 正四面体分子中键角只能是109°28′ |
考点:
元素电离能、电负性的含义及应用;同一主族内元素性质递变规律与原子结构的关系;化学键;键能、键长、键角及其应用.
分析:
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素;
B.氟元素没有正价;
C.稀有气体为氮原子分子,分子间通过分子间作用力形成分子晶体;
D.白磷是正四面体结构,但是键角60°.
解答:
解:A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族和第VA族元素第一电离能大于其相邻元素,所以P元素第一电离能大于S元素,故A正确;
B.氟元素只有负价,没有正价,故B错误;
C.稀有气体为分子晶体,不存在化学键,故C错误;
D.白磷是正四面体结构,但是键角60°,故D错误;
故选:A.
点评:
本题为综合题,考查了第一电离能大小判断、元素化合价与族序数的关系、化学键、键角等知识点,题目难度中等,侧重考查学生对物质结构和元素周期律等基本理论的考查,注意一般规律中的异常现象.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
下列离子方程式中,正确的是( )
|
| A. | 碳酸氢钙溶液与足量盐酸反应Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑ |
|
| B. | 稀盐酸和碳酸钙反应 CO32﹣+2H+=CO2↑+H2O |
|
| C. | 碳酸钠溶液与醋酸反应 CO32﹣+2H+=CO2↑+H2O |
|
| D. | 大理石溶于醋酸的反应 CaCO3+2CH3COOH=Ca2++2CH3COO﹣+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学平衡常数的说法中,正确的是( )
|
| A. | 在任何条件下,化学平衡常数都是一个定值 |
|
| B. | 当改变反应物的浓度时,化学平衡常数会发生改变 |
|
| C. | 化学平衡常数K只与温度、反应物浓度、体系的压强都有关 |
|
| D. | 化学平衡常数K可以推断一个可逆反应进行的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列微粒的个数比不是1:1的是( )
|
| A. | NaCl晶体中阴、阳离子 | B. | NH3分子中的质子和电子 |
|
| C. | Na2O2固体中阴、阳离子 | D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 标准状况下,含NA个氩原子的氩气的体积约为11.2 L |
|
| B. | 31g白磷分子中,含有的共价单键数目是NA个 |
|
| C. | 6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 |
|
| D. | 4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
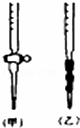
阅读下列实验内容,根据题目要求回答问题.
某学生为测定未知浓度的硫酸溶液,实验如下:以0.14mol•L﹣1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol•L﹣1NaOH溶液滴定硫酸的实验操作如下:
A、检查滴定管是否漏水
B、用蒸馏水洗干净滴定管
C、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2﹣3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
D、用待测定的溶液润洗酸式滴定管
E、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入指示剂.
F、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G、另取锥形瓶,再重复操作一次
①该滴定操作中应选用的指示剂是 ;
②在F操作中如何确定终点? .
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中.
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) .
(4)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com