
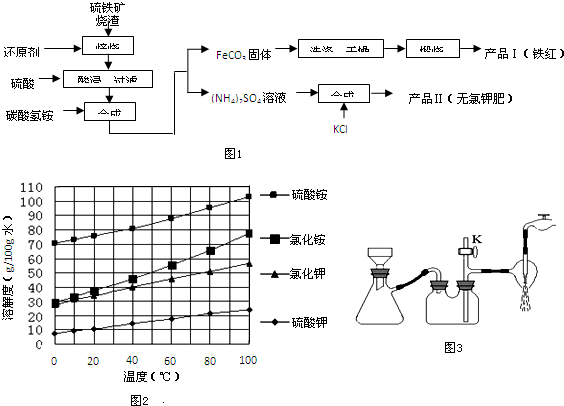
分析 利用硫铁矿烧渣制备铁红等产品的实验流程为:Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤后所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵;碳酸亚铁与氧气反应生成了氧化铁、二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
(1)根据图示,碳酸亚铁煅烧生成氧化铁和二氧化碳气体;根据煅烧操作的方法写出使用的仪器名称;
(2)为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,根据溶解度不同选用操作方法;
(3)分离粗产品Ⅱ时承接滤液的烧杯中应加入少量蒸馏水;若实验过程中发现倒吸现象,应采取的措施是打开旋塞K;
(4)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热;根据硫酸亚铁铵晶体不溶于乙醇分析;
(5)①溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点.
②根据关系式5Fe2+~MnO4-,计算4g产品中Fe2+的物质的量,进而计算Fe2+的质量,再根据质量分数定义计算.
解答 解:Fe2O3、Fe3O4、FeO与还原剂反应生成铁,铁和稀硫酸反应生成硫酸亚铁和氢气,过滤后所以滤液中的主要溶质是硫酸亚铁;硫酸亚铁与碳酸氢铵反应得到碳酸亚铁和硫酸铵;碳酸亚铁与氧气反应生成了氧化铁、二氧化碳;硫酸铵与氯化钾反应生成硫酸钾和氯化铵,根据硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
(1)碳酸亚铁与氧气反应生成了氧化铁盒二氧化碳,反应的化学方程式为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2;
因实验室进行煅烧操作所需仪器有:酒精灯、泥三角、三脚架、玻璃棒、坩埚、坩埚钳,还缺少的仪器为:坩埚、坩埚钳,
故答案为:4FeCO3+O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+4CO2; 坩埚、坩埚钳;
(2)硫酸铵与氯化钾反应生成硫酸钾和氯化铵;因硫酸钾的溶解度随温度变化不大,可用蒸发结晶、趁热过滤、洗涤、干燥得到硫酸钾,
故答案为:蒸发结晶、趁热过滤、洗涤、干燥;
(3)分离粗产品Ⅱ时承接滤液中含有氯化铵,先向烧杯中应加入少量蒸馏水,分离粗产品Ⅱ后的滤液冷却至室温后,进行减压抽滤,得粗产品Ⅲ;所用的装置如图3所示,若实验过程中发现倒吸现象,应采取的措施为:打开旋塞K,降低倒吸现象,
故答案为:蒸馏水;打开旋塞K;
(4)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,通过减压过滤(或抽滤)等得到较为干燥的晶体;由于硫酸亚铁铵晶体不溶于乙醇,可以用乙醇洗去晶体表面的水,
故答案为:溶液表面出现晶膜为止;除去晶体表面附着的水分;
(5)①溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点.
故答案为:溶液由无(浅绿)色变为浅紫色,半分钟内不褪色,说明滴定到终点.
⑤令4g产品中Fe2+的物质的量为xmol,则:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.01L×0.2mol/L
所以x=$\frac{0.01L×0.2mol/L×5}{1}$=0.01mol.
所以4g产品中(NH4)2Fe(SO4)2的物质的量为0.01mol,质量为0.01mol×284g/mol=2.84g.
所以4g产品中(NH4)2Fe(SO4)2的纯度为$\frac{2.84g}{4g}$×100%=71%.
故答案为:71%.
点评 本题综合考查物质的分离、提纯以及制备,为高考常见题型,题目难度较大,试题侧重于学生的分析能力和实验能力的考查,注意把握实验的目的和原理.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | H+H→H-H | |
| B. | Mg+2HCl═MgCl2+H2↑ | |
| C. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
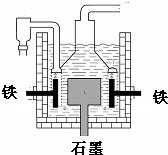 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )
早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为:4NaOH(熔融)═4Na+O2↑+2H2O;后来盖•吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH═Fe3O4+2H2↑+4Na↑.下列有关说法正确的是( )| A. | 电解熔融氢氧化钠制钠,阳极发生电极反应为:Na++e-=Na | |
| B. | 盖•吕萨克法制钠原理是利用铁的还原性比钠强 | |
| C. | 若戴维法与盖•吕萨克法制得等量的钠,则两反应中转移的电子总数比为2:1 | |
| D. | 目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NaHSO3溶液中:c(OH-)-c(H+)=c(SO32-)-c(H2SO3) | |
| B. | 1L 0.1mol/L的(NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | |
| C. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| D. | 向0.01mol/L的NH4HSO4溶液中滴加NaOH溶液至中性时:c(SO42-)>c(Na+)=c(NH4+)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | SiO2能形成原子晶体,一定条件下CO2也能形成原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
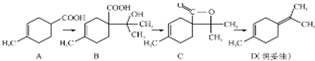 胡妥油(D)用作香料的原料,它可由A合成得到:
胡妥油(D)用作香料的原料,它可由A合成得到:| A. | 按系统命名法有机物A的名称为3-甲基-3-环已烯甲酸 | |
| B. | 如果条件合适,B可能发生加聚反应,也可能发生缩聚反应 | |
| C. | C 的分子式为C10H14O2 | |
| D. | D 与Br2的CCl4溶液反应,最多有4种生成物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
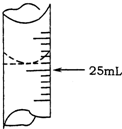 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
已知,A是常见的金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时产生苍白色火焰.A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com