
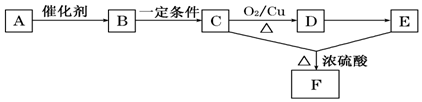
分析 A是天然有机高分子化合物,C可发生催化氧化,结合图中转化可知,A为淀粉,水解生成B为葡萄糖,B发生酒化反应生成C为CH3CH2OH,D为CH3CHO,E为CH3COOH,F为CH3COOCH2CH3,以此来解答.
解答 解:(1)B为葡萄糖,D为乙醛,均含有醛基,故答案为:醛基;
(2)C到D所发生反应的化学方程式为2CH3CHO+O2$→_{△}^{Cu}$2CH3CHO+2H2O,故答案为:2CH3CHO+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(3)A→B发生水解反应,B→C发生分解反应,C→D发生氧化反应,D→E为氧化反应,C、E发生酯化反应生成F,故答案为:ABD.
点评 本题考查有机物的推断,为高频考点,把握高分子化合物A为淀粉为解答的关键,侧重分析与推断能力的考查,注意有机反应及有机物的性质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | S、Cl、O、F的原子半径依次减小 | |
| B. | Na、Mg、Al、Si的失电子能力依次增强 | |
| C. | C、N、O、F的气态氢化物的稳定性依次增强 | |
| D. | Si、P、S、Cl的最高价含氧酸的酸性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将洁净的铜丝在酒精灯外焰灼烧后慢慢移向内焰 | 验证铜可作为乙醇氧化为乙醛的催化剂 |
| B | 向饱和碳酸钠溶液中通入CO2 | 比较相同温度下碳酸钠和碳酸氢钠的溶解度 |
| C | 用锌片和稀硫酸制备H2时,滴加几滴Cu(NO3)2溶液 | 加快制备H2的反应速率 |
| D | 向5mL0.1mol•L-1KI溶液中滴入0.1mol•L-1FeCl3溶液5~6滴,加2mLCCl4振荡,静置后取上层清液滴加KSCN溶液,观察现象 | 验证Fe3+与I-的反应可逆 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极:Cd-2e-═Cd2+ | |
| B. | 放电时正极:2NiOOH+2e-+2H2O═2Ni(OH)2+2OH- | |
| C. | 充电时阳极:2Ni(OH)2-2e-+4H+═2Ni3++4H2O | |
| D. | 充电时含Cd的电极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 切开的金属Na暴露在空气中,光亮的表面逐渐变暗,发生的反应为2Na+O2═Na2O2 | |
| B. | 单质钠具有很强的还原性,钠离子具有很弱的氧化性 | |
| C. | Na着火时不能用水灭火,可用细沙覆盖灭火 | |
| D. | 将少量Na投入到CuSO4溶液中,既有沉淀生成又有气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、SO42-、Fe3+、Cl- | B. | S2-、Cu2+、Na+、Cl- | ||
| C. | H+、SO42-、Cu2+、OH- | D. | Fe2+、H+、Mg2+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
| C | 胆矾 | 盐酸 | 铁 | 碳酸钙 |
| D | 胆矾 | 水蒸气 | 氯化铜 | 碳酸钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
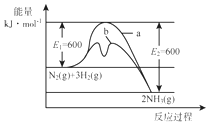 氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法.| 编号 | 温度/K | 反应时间/h | 反应物质的量配比 | 实验目的 |
| ① | 573 | 4 | 1:3 | 实验②和④探究温度对产率的影响 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 实验②和③探究反应时间对 产率的影响 |
| ④ | 673 | 4 | 1:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com