

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
分析 侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,总化学反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,C装置为反应发生装置,装有盐酸、碳酸钙,制取CO2气体,B装置为尾气处理装置,装有稀硫酸,吸收反应中过量的NH3,D中装有含氨的饱和食盐水、水,反应要制取NaHCO3,需要除去反应产生的HCl气体,则可判断A装置中应装的是饱和NaHCO3溶液,目的是除去HCl气体,据此分析解答.
解答 解:侯氏制碱法,也称为联合制碱法,化学反应原理是用氨气和二氧化碳与氯化钠饱和溶液反应生成碳酸氢钠,然后加热碳酸氢钠制取碳酸钠,总化学反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,C装置为反应发生装置,装有盐酸、碳酸钙,制取CO2气体,B装置为尾气处理装置,装有稀硫酸,吸收反应中过量的NH3,D中装有含氨的饱和食盐水、水,反应要制取NaHCO3,需要除去反应产生的HCl气体,则可判断A装置中应装的是饱和NaHCO3溶液,目的是除去HCl气体,
(1)C装置为反应发生装置,B装置为尾气处理装置,装有稀硫酸,吸收反应中过量的NH3,D中装有含氨的饱和食盐水、水,反应要制取NaHCO3,则可判断A装置中应装的是饱和NaHCO3溶液,因此装置连接顺序为:CADB,
故答案为:CADB;
(2)利用NaHCO3的溶解度较小,可以析出晶体,可判断A中装的是NaHCO3饱和溶液,作用是除去CO2中的HCl,
故答案为:饱和NaHCO3溶液;除去CO2中的HCl;
(3)D为制取NaHCO3晶体,根据溶解度数据,反应应是先产生NH4HCO3,然后由于NaHCO3的溶解度比NH4HCO3小,对其进行降温处理,继而析出NaHCO3晶体,而要控制温度在30℃~35℃,是由于碳酸氢铵易受热分解,而温度太低,化学反应速率太慢,
故答案为:温度超过35℃,碳酸氢铵开始分解,温度太低,反应速率降低,不利于反应进行;
(4)反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体.用蒸馏水洗涤NaHCO3晶体的目的是除去NaCl、NH4C1、NH4HCO3杂质,
故答案为:NaCl、NH4C1、NH4HCO3;
(5)将锥形瓶中的产物过滤后,所得的母液中含有NaHCO3、NaCl、NH4C1、NH4HCO3,加入氯化氢,还可以产生NaCl,而NaCl又是反应的原料,达到循环利用的目的,需进行结晶操作,
故答案为:NaHCO3、NaCl、NH4C1、NH4HCO3;结晶.
点评 本题主要考察侯氏制碱法的原理,结合实验目的和实验过程分析,弄清每步实验的目的是解答的关键,本题难度中等.


科目:高中化学 来源: 题型:选择题
 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中不正确的是( )
已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中不正确的是( )| A. | 每生成2分子AB吸收b kJ热量 | |
| B. | 该反应热△H=+(a-b) kJ•mol-1 | |
| C. | 该反应中反应物的总能量低于生成物的总能量 | |
| D. | 分别断裂1 molA2和1 molB2中的化学键,共吸收a kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,33.6L CH3Cl中含有H原子数小于4.5NA | |
| B. | 1mol 18O2 中含有的质子数为20NA | |
| C. | 一定条件下,26g乙炔和苯混合气体含有C原子数为2NA | |
| D. | 电解精炼铜时,电路中转移电子数为2NA时,理论上阴极的质量增加64g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O,Fe2O3、A12O3属于碱性氧化物,CO2、SO2、NO2都能和碱溶液发生反应属于酸性氧化物 | |
| B. | CaCl2、NaOH、HCl、HD四种物质都属于化合物 | |
| C. | 蔗糖、硝酸钾和硫酸钡分别属于非电解质、强电解质和弱电解质 | |
| D. | 醋酸、烧碱、纯碱和生石灰分别属于酸、碱、盐和氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  所示装置制取并观察Fe(OH)2 | |
| B. | 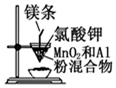 所示装置制取金属锰 | |
| C. |  所示装置配制100 mL 0.1 mol•L-1 硫酸溶液 | |
| D. |  所示装置比较N、C、Si的非金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图中a表示阳离子交换膜 | |
| B. | 当电路中通过1mol电子的电量时,会有0.25mol的O2生成 | |
| C. | 甲为NaOH溶液 | |
| D. | 阳极的电极反应式为SO32-+H2O-2e-=SO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  装置关闭止水夹,往长颈漏斗加水,根据水位的变化情况可检查该装置的气密性 | |
| B. | 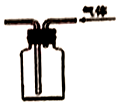 装置可用来收集NH3、H2等 | |
| C. |  装置可用来吸收极易溶于水的气体如NH3、HCl等 | |
| D. |  装置洗涤沉淀物时,向漏斗中加蒸馏水至浸没沉淀物,滤出溶液并重复操作2-3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ④⑤③①② | C. | ②①③⑤④ | D. | ⑤④③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3,3-二甲基-4-乙基戊烷 | B. | 3,4-二甲基-4-乙基戊烷 | ||
| C. | 3,3,4-三甲基己烷 | D. | 3,4,4-三甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com