
分析 (1)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答;
(2)碱性条件下CO在负极放电生成CO32-;
(3)催化剂的特点,恢复原来状态,Fe3+→Fe2+;高锰酸钾溶液是利用硫酸酸化的,据此解答即可;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍;
(5)根据盖斯定律,由已知热化学方程式构造目标热化学方程式.
解答 解:(1)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物;混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(2)原电池中,负极上CO失电子和氢氧根离子反应生成CO32-,所以电极反应式为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O;
(3)根据催化剂的特点,另一个反应一定有Fe3+→Fe2+,反应方程式为 2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,由于高锰酸钾溶液是由硫酸酸化的,故利用氢氧化钡与吸收过二氧化硫的高锰酸钾溶液反应会导致测定的二氧化硫的含量偏高,
故答案为:2Fe3++SO2+2H2 O═2Fe2++SO42-+4H+;偏高;高锰酸钾溶液是用硫酸酸化的,含硫酸根;
(4)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=$\frac{1}{2}$×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)•c(Ca2+)=2.8×10-9可知,c(Ca2+)=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L;
(5)已知:①CH3OH(l)+O2(g)═CO(g)+2H2O(g);△H=-359.8kJ•mol-1
②2CO(g)+O2(g)═2CO2(g);△H=-556.0kJ•mol-1
③H2O(g)═H2O(l);△H=-44.0kJ•mol-1
根据盖斯定律:①+$\frac{1}{2}$×②+2×③得CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.8 kJ•mol-1.
点评 本题考查了盐的水解,溶度积常数的有关计算,热化学方程式和盖斯定律的计算应用,原电池的应用等,涉及的知识点较多,题目难度中等,注意是对反应原理的应用的考查.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
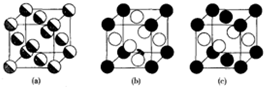 Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:
Cu、Ag、Au同为第一副族的元素,它们的性质也有不同之处,如:它们在水溶液中最稳定的氧化态分别为+2,+1和+3,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
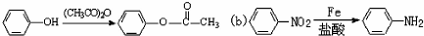
 ;
;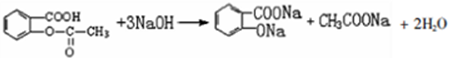 ;
;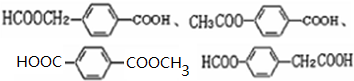 ;
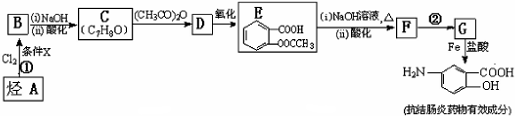
; 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物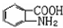 的合成路线
的合成路线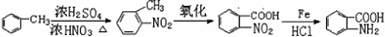 ..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
..(依照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含0.1 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是IIA元素 | |
| B. | 一定是金属元素 | |
| C. | 一定是正二价元素 | |
| D. | 可能是金属元素,也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
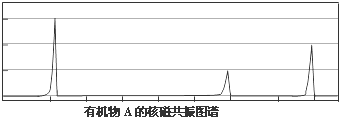
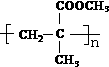 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com