
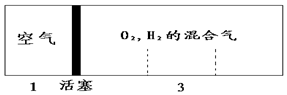
 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )| A. | 1:2 | B. | 3:2 | C. | 5:2 | D. | 7:2 |
分析 反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,剩余的气体可能为氢气,也可能为氧气,据此讨论计算.
解答 解:反应前左右压强都相等,气体的物质的量之比等于体积之比,令空气的物质的量为1mol,则氢气、氧气的混合气体为3mol.反应后恢复至原来的温度,活塞正好停留在容器的中间.说明反应后左右气体的物质的量相等,右室中剩余气体为1mol,
若剩余的气体为氢气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氧气为2mol×$\frac{1}{3}$=$\frac{2}{3}$mol,故氢气为3mol-$\frac{2}{3}$mol=$\frac{7}{3}$mol,故H2、O2的体积比为$\frac{7}{3}$mol:$\frac{2}{3}$mol=7:2;
若剩余的气体为氧气,参加反应气体共2mol,由2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氢气为2mol×$\frac{2}{3}$=$\frac{4}{3}$mol,故氧气为3mol-$\frac{4}{3}$mol=$\frac{5}{3}$mol,故H2、O2的体积比为$\frac{4}{3}$mol:$\frac{5}{3}$mol=4:5,
故选D.
点评 本题考查化学方程式的有关计算,侧重考查学生分析计算能力,明确左右室的气体的物质的量关系是解答本题的关键,注意:该反应中可能是氧气过量也可能是氢气过量,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 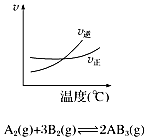 如图说明此反应的正反应是吸热反应 | |
| B. | 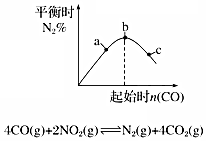 如图说明NO2的转化率b>a>c | |
| C. |  如图说明反应至15 min时,改变的条件是升高温度 | |
| D. |  如图说明生成物D一定是气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 920 mL,107.64 g | B. | 500 mL,117 g | ||
| C. | 1000 mL,117.0g | D. | 任意规格,107.64 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com