
 百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )
百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧.其主要化学成分的结构简式如图,下列有关该有机物的叙述正确的是( )| A. | 分子式为C8H10NO2 | |
| B. | 该有机物属于α-氨基酸 | |
| C. | 该有机物属于α-氨基酸的同分异构体有3种 | |
| D. | 该有机物与FeCl3溶液发生显色反应 |
 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应 | |
| B. | W的氢化物水溶液是强酸 | |
| C. | Y元素的氢化物在同周期中是最稳定的 | |
| D. | 元素Y和W只能形成一种化合物 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:简答题
2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g)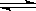 CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。

(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g) 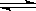 CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:

①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线

(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g) =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.
,请写出尿素的同分异构体中含有离子键的化学式NH4OCN.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,如图所示,四种物质间反应的离子方程式书写不正确的是( )
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见的物质,如图所示,四种物质间反应的离子方程式书写不正确的是( )| A. | OH-+H+═H2O | B. | 2OH-+Cu2+═Cu(OH)2↓ | ||
| C. | Fe+Cu2+═Cu+Fe2+ | D. | Fe+2H+═Fe3++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | Na2O2与足量H2O反应产生0.1molO2,转移电子的数目为0.2NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2溶液中加入Na的小颗粒 | B. | 饱和Ca(OH)2溶液中加入Na的小颗粒 | ||
| C. | KNO3稀溶液中加入Na的小颗粒 | D. | FeCl2溶液中加入Na的小颗粒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com