
【题目】用足量的盐酸跟一定量的锌反应制取一定体积的氢气,为了提高化学反应速率而又不影响生成氢气的体积,下列措施中合理的是( )
A.加入少量稀硫酸 B.加热
C.加蒸馏水 D.加入少量硫酸铜溶液
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述中,错误的是
A.油脂分子结构中三个烃基一定相同
B.可以用纯碱溶液去除油污
C.可以用纯碱区别植物油和柴油
D.工业上可用油脂制造高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线稍下,并记下读数
④量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
请回答:
(1)以上步骤有错误的是(填编号) 。
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:______(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失
(4)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视 。判断到达滴定终点的现象是:锥形瓶中溶液 。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.30 |
2 | 20.00 | 0.00 | 16.30 |
3 | 20.00 | 0.00 | 16.32 |
通过计算可得,该盐酸浓度为:______ molL-1(计算结果保留4位小数)
II、利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤1:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤2:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤:1相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
则BaCl2溶液浓度为______________________ mol·L-1。若步骤2中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
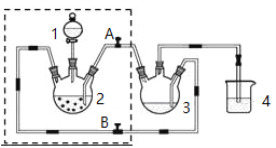
【题目】实验室制备醋酸亚铬水合物的装置如图所示, 涉及的化学方程式如下:
Zn(s)+2HCl(aq)= ZnCl2(aq)+H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O (s)
醋酸亚铬水合物([Cr(CH3COO)2)]22H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。
请回答下列问题:
(1)检查虚框内装置气密性的方法是_____________________________________。
(2)本实验中所有配制溶液的水需煮沸,其原因是_________________________________。装置4的作用是_________________________。
(3)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是_________阀门A、__________阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是__________________________________。
(5)为洗涤[Cr(CH3COO)2)]22H2O产品,下列方法中最适合的是________________。
A.先用盐酸洗,后用冷水洗
B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗
D.先用乙醇洗涤,后用乙醚洗
(6)铬元素在很多领域都有应用。氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。写出铬元素的基态原子外围电子排布式:_________________;与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有_______________(填名称);CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱工艺。其纯碱制造原理如下图所示:

(1)由NaHCO3制备纯碱的化学方程式是_________________。
(2)过程Ⅰ通入NH3和CO2的顺序是__________________。
(3)过程Ⅱ析出NH4Cl(s)的原因是_____________。
(4)充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率往往很低,原因是________________。
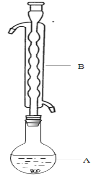
(5)采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。

① 低于300℃时,干燥管盛装的干燥剂是_________。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是_________________。
③ 在350℃~600℃,上图虚线框内应选择的安全瓶是________。

④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是____________(结合化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的操作中错误的是
A.除去石英中少量的碳酸钙:用稀盐酸溶解后过滤
B.FeCl2溶液中混有的FeCl3:加入过量的铁粉充分反应后过滤
C.除去氢氧化铁胶体中的铁离子用渗析的方法
D.氯气混有少量氯化氢气体:将混合气体通过盛NaOH溶液的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3俗称大苏打(海波)是重要的化工原料。用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3·5H2O。
现实验室欲制取Na2S2O3·5H2O晶体(Na2S2O3·5H2O的分子量为248)步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水。
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中。
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤。
④滤液在经过 、 后析出Na2S2O3·5H2O晶体。
⑤进行减压过滤并干燥。
(1)仪器B的名称是________。其作用是___________。加入的硫粉用乙醇润湿的目的是 。
(2)步骤④应采取的操作是 、 。
(3)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。如果滤液中该杂质的含量不很低,其检测的方法是: 。
(4)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用 (填“酸式”或“碱式”)滴定管来滴定(2S2O32- + I2 = S4O62- + 2I-),滴定结果如下:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起误差) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由反应物X转化为Y和由反应物X转化为Z的能量变化如图所示。下列说法正确的是
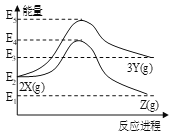
A. 2X(g)![]() 3Y(g)反应的ΔH=E5E2
3Y(g)反应的ΔH=E5E2
B. 2X(g)![]() Z(g)反应的ΔH<0
Z(g)反应的ΔH<0
C. 增大压强有利于提高Y的产率
D. 升高温度有利于提高Z的产率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com