
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的主族序数 | |
| C. | 短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 | |
| D. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 |
分析 A.处于金属与非金属交界处的元素通常表现一定的金属性与非金属性;
B.第三周期主族元素中,最高正价=族序数=最外层电子数;
C.氢离子核外没有电子,锂离子核外只有2个电子;
D.同主族元素原子最外层电子数相同,化学性质具有相似性,自上而下原子半径增大,化学性质具有递变性.
解答 解:A.处于金属与非金属交界处的元素通常表现一定的金属性与非金属性,故A错误;
B.第三周期主族元素中,最高正价=族序数=最外层电子数,则第三周期主族元素的最高化合价等于它所在的主族序数,故B正确;
C.氢离子核外没有电子,锂离子核外只有2个电子,不满足最外层都能达到8电子稳定结构,故C错误;
D.同主族元素原子最外层电子数相同,自上而下原子半径增大,化学性质具有相似性、递变性,化学性质不完全相同,故D错误,
故选B.
点评 本题考查元素周期律与元素周期表的综合应用,难度不大,侧重对基础知识的巩固,注意短周期元素的特殊性.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
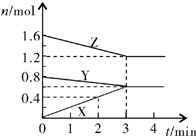 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 细菌冶金能充分利用资源和废物,能耗低 | |
| B. | 细菌冶金不产生二氧化硫等有毒气体,环境污染少 | |
| C. | 细菌冶金温度越高,化学反应速率越快,采矿效率越高 | |
| D. | 推广细菌冶金体现了绿色化学理念,有利于经济可持续发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能与氢气发生加成反应 | B. | 葡萄糖能发生氧化反应和水解反应 | ||
| C. | 淀粉水解的最终产物是葡萄糖 | D. | 蛋白质遇浓硫酸变为黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡C-CH2CH3 | B. | CH3C≡CH | C. | CH3CH2CH═CH2 | D. | CH2═CH-CH═CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
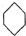 (g)?3H2(g)+
(g)?3H2(g)+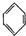 (g)△H1
(g)△H1 (g)+H2(g)→
(g)+H2(g)→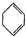 (g)△H2=+28.6KJ/mol
(g)△H2=+28.6KJ/mol (g)+2H2(g)→
(g)+2H2(g)→ (g)△H3=-237KJ•mol-1
(g)△H3=-237KJ•mol-1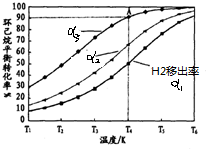
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,1.7gH2O2中含有的电子数为0.9nA | |
| B. | 1L1 mol.L-1CuCl2溶液含有2nA个Cl- | |
| C. | 1 mol Na 与足量 O2反应,生成Na2O和Na2O2的混合物,钠失去2nA个电子 | |
| D. | 标准状况下,2.24L戊烷所含分子数为0.1nA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com