


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 |
| D、C点溶液中的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu2+、Na+、NO3-、Cl- |
| B、NH4+、Mg2+、NO3-、CO32- |
| C、Ag+、Na+、CO3-、Cl- |
| D、Na+、K+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
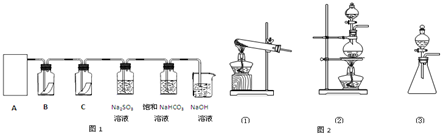
 为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中.| 题号 | 实 验 要 求 | |
| (1) | 从碘水中提取碘单质 | |
| (2) | 提纯混有少混NaCl的KNO3 | |
| (3) | 鉴别NaCl和KCl | |
| (4) | 测定某工业废水的酸碱度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
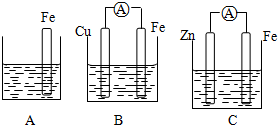
科目:高中化学 来源: 题型:
| ||
| △ |
| 改变条件 | 速率变化 |
| 降低温度 | |
| 增加O2的浓度 | |
| 使用V2O5做催化剂 | |
| 压缩气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com