
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CO32-、Cl-、OH-、SO42- |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |
| 10-10 |
| 10-4 |
| VC×0.15mol/L×2-V碳酸×0.2mol/L |
| VC+V盐酸 |


科目:高中化学 来源: 题型:
| A、H2 |
| B、HCl |
| C、Cl2 |
| D、F2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是物质量的单位 |
| B、常温下,1mol NH3的质量小于17g |
| C、氦气的摩尔质量是4g/mol |
| D、1mol气体所占的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 400 | 500 | 600 |
| SO2转化率/% | 99.2 | 93.5 | 73.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
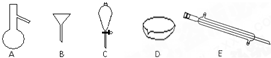
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
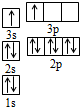 有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
有A、B、C、D四种元素.已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大.B 的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同,B位于元素周期表的s区.C元素原子的外围电子层排布式为nsn-1npn-1. D原子M能层为全充满状态,且核外的未成对电子只有一个.请回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com