
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
【答案】 0.1mol 1120 小于 18mol/L
【解析】本题考查化学计算,(1)发生的反应是Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,因为硫酸是过量的,因此根据铜进行计算,消耗硫酸的物质的量为n(H2SO4)=2n(Cu)=2×3.2/64mol=0.1mol,产生V(SO2)=3.2×22.4×1000/22.4mL=1120mL;(2)硫酸不足,铜过量,因此根据硫酸进行计算,被还原硫酸的物质的量为50×10-3×a/2mol=0.025amol,但铜只与浓硫酸反应,随着反应的进行,硫酸浓度降低,转化成稀硫酸,反应停止,即被还原的稀硫酸的物质的量小于0.025amol;(3)根据反应方程式,硫酸一部分起酸性,一部分作氧化剂,因此根据硫元素守恒,n(H2SO4)=[n(SO42-)+n(SO2)] mol=(
CuSO4+SO2↑+2H2O,因为硫酸是过量的,因此根据铜进行计算,消耗硫酸的物质的量为n(H2SO4)=2n(Cu)=2×3.2/64mol=0.1mol,产生V(SO2)=3.2×22.4×1000/22.4mL=1120mL;(2)硫酸不足,铜过量,因此根据硫酸进行计算,被还原硫酸的物质的量为50×10-3×a/2mol=0.025amol,但铜只与浓硫酸反应,随着反应的进行,硫酸浓度降低,转化成稀硫酸,反应停止,即被还原的稀硫酸的物质的量小于0.025amol;(3)根据反应方程式,硫酸一部分起酸性,一部分作氧化剂,因此根据硫元素守恒,n(H2SO4)=[n(SO42-)+n(SO2)] mol=( ![]() +
+![]() ) mol=0.9mol,因此c(H2SO4)=0.9/(50×10-3)mol·L-1=18mol·L-1。
) mol=0.9mol,因此c(H2SO4)=0.9/(50×10-3)mol·L-1=18mol·L-1。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述中正确的是( )
A.稀硝酸是弱酸,浓硝酸是强酸
B.铜与浓硝酸和稀硝酸都能发生反应生成二氧化氮
C.浓硝酸能使紫色石蕊溶液先变红后褪色
D.稀硝酸与活泼金属反应放出氢气,而浓硝酸则使金属钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
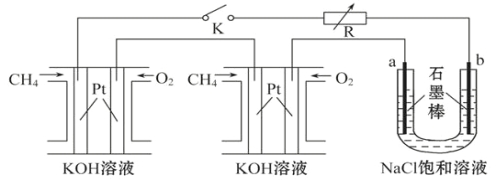
回答下列问题:
(1)甲烷燃料电池正极的电极反应为________________、负极的电极反应____________。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是____________,电解氯化钠溶液的总反应方程式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
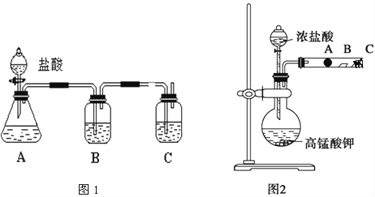
(1)甲同学设计实验的理论依据是_____________________________________;
写出选用药品分别为:A____________,B__________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验理论依据是______________________________________;
A处的现象是: ___________________________________________;
写出B处的离子方程式_____________,C处药品的作用 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A+3B2C+D在某段时间内以A的浓度变化表示的化学反应速度为1molL﹣1min﹣1 , 则此段时间内以C的浓度变化表示的化学反应速率为( )
A.0.5molL﹣1min﹣1
B.1molL﹣1min﹣1
C.2molL﹣1min﹣1
D.3molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
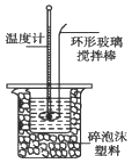
(1)写出该反应的热化学方程式(中和热为57.3 kJ/mol): 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是: (填字母)。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. 增加X的物质的量,Y的转化率降低
C. 降低温度,混合气体的平均相对分子质量变小
D. X的正反应速率是Y的逆反应速率的m/n倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅元素有+2价、+4价两种常用价态,铅及其化合物可用于耐酸设备及X射线防护等。
(1)我国古代炼丹中经常使用到红丹(用X表示),在一定条件下,与过量硝酸能发生非氧化还原反应:X+4HNO3===PbO2+2Pb(NO3)2+2H2O(已配平)。
①PbO2中铅元素的化合价是________,PbO2不是碱性氧化物,判断的依据是_________________________________________________。
②X的化学式是________。
(2)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为____________________________________________。
(3)PbO2在加热的过程中发生分解生成PbO和O2,其失重曲线如图所示,已知失重曲线上的a点为样品分解40%的残留固体。若a点固体组成表示为PbOx,则x=________。
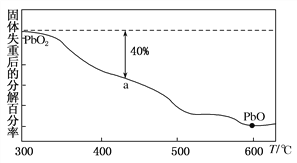
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com