
 氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
氮氧化物排放是形成臭氧层空洞、酸雨、雾霾的重要成因之一.SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0分析 (1)①NO+O3?NO2+O2 反应①的平衡常数为K1=$\frac{c(N{O}_{2})c({O}_{2})}{c(NO)c({O}_{3})}$,②NO2+O?NO+O2 反应②的平衡常数为K2=$\frac{c({O}_{2})c(NO)}{c(N{O}_{2})c(O)}$,反应O3+O?2O2的平衡常数K=$\frac{{c}^{2}({O}_{2})}{c({O}_{3})c(O)}$,据此分析计算;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
减少副反应应使副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理;
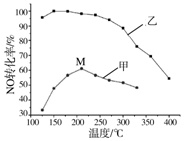
(3)①图象中催化剂在低温下NO转化率大;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小;高于210℃时,NO转化率降低是催化剂活性降低;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O.
解答 解:(1)①NO+O3?NO2+O2 反应①的平衡常数为K1=$\frac{c(N{O}_{2})c({O}_{2})}{c(NO)c({O}_{3})}$,②NO2+O?NO+O2 反应②的平衡常数为K2=$\frac{c({O}_{2})c(NO)}{c(N{O}_{2})c(O)}$,反应O3+O?2O2的平衡常数K=$\frac{{c}^{2}({O}_{2})}{c({O}_{3})c(O)}$,据此分析计算得到K=K1•K2,一氧化氮反应生成二氧化氮,二氧化氮反应又生成一氧化氮,说明氮氧化物在该反应中的作用是催化剂的作用,
故答案为:K1•K2;
(2)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0,提高NO平衡转化率改变条件使平衡正向进行;
反应为气体体积增大的放热反应,可以降低温度、减小压强使平衡正向进行,减少副反应应使副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)平衡逆向进行,结合化学平衡移动原理分析,需要选择合适的催化剂、控制氧气用量促进4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0反应进行,避免副反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)进行,
故答案为:降低温度、减小压强;选择合适的催化剂、控制氧气用量;
(3)①图象中曲线变化可知低温下乙的催化作用强,工业上选择催化剂乙的原因是低温下有很强的催化活性,
故答案为:低温下有很强的催化活性;
②甲催化剂随温度升高NO转化率先增大后减小是因为催化剂在温度高的条件下催化活性减小,在催化剂甲作用下,图中M点处(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率,高于210℃时,NO转化率降低是催化剂活性降低,副反应增多,
故答案为:一定不是;催化剂活性降低、副反应增多;
(4)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g)+4NO(g)+O2(g)?4N2(g)+6H2O(g)△H<0
尿素[(NH2)2CO]还原NO,既安全又高效,且产物都是空气中含有的成分,反应的化学方程式为2(NH2)2CO+6NO=5N2+2CO2+4H2O,等物质的量的尿素与氨气可消除的NO物质的量之比=12:4=3:1,
故答案为:3:1.
点评 本题考查了好像平衡影响因素、平衡常数计算、图象分析判断、催化剂作用的理解应用,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
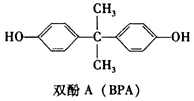
| A. | 双酚A分子的核磁共振谱有4组峰 | |
| B. | 双酚A分子中所有的碳原子可能共平面 | |
| C. | 1mol双酚A最多可与2molBr2反应 | |
| D. | 双酚A与足量H2反应的产物属于芳香醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
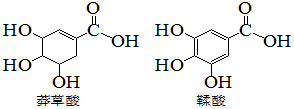
| A. | 莽草酸分子式为C7H10O5 | |
| B. | 两种酸都能与溴水发生加成反应 | |
| C. | 鞣酸分子与莽草酸分子互为同系物 | |
| D. | 等物质的量的两种酸与足量氢氧化钠反应,消耗氢氧化钠的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1的Na2A溶液中,c(A2-)+c(HA-)+2c(Na+)=0.5mol•L-1 | |
| B. | 在0.1mol•L-1的H2A溶液中,c(H+)>0.12mol•L-1 | |
| C. | 将同浓度(0.1mol•L-1)的NaHA和Na2A溶液等体积混合,混合溶液可能呈碱性 | |
| D. | 0.1mol•L-1的NaHA溶液中离子浓度为c(Na+)>c(H+)>c(A2-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
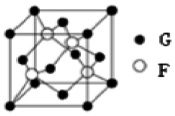 A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.
A、B、C、D、E、F、G七种元素位于元素周期表前四周期,原子序数依次增大.元素周期表中原子半径最小的是A,B原子最外层有两个未成对电子,化合物CD2为红棕色气体,E的单质易与水反应且只作氧化剂,元素F基态原子的3p轨道上有5个电子,G是第四周期元素,最外层只有一个电子,其余各层电子均充满.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ•mol-1) | 436 | 157 | 568 | 432 | 298 |
| A. | 432kJ•mol-1>E(H-Br)>298kJ•mol-1 | B. | H2(g)+F2(g)=2HF(g)△H=25kJ•mol-1 | ||
| C. | 表中最稳定的共价键是H-F | D. | H2(g)→2H(g)△H=+436kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 离子化合物中可能含有共价键 | |
| B. | 阴、阳离子间通过静电作用所形成的化学键是离子键 | |
| C. | 溶于水可以导电的化合物一定是离子化合物 | |
| D. | 需要加热的化学反应一定是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: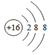 | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为7 的碳原子:${\;}_{6}^{7}$C | D. | CO2 的电子式: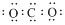 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以淀粉为原料可以制取乙酸乙酸 | |
| B. | 油脂的皂化反应属于加成反应 | |
| C. | 乙酸中所有原子可能处于同一平面 | |
| D. | 分子式为C3H6Cl2的同分异构体有5种(不考虑立体异构) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com