
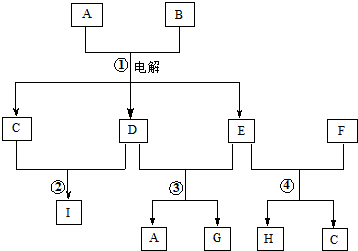
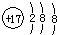 ,
,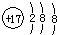 ;
;

科目:高中化学 来源: 题型:
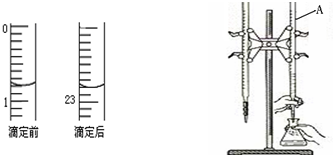 如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol?mol-1的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 |
待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水的浓度大于盐酸的浓度 |
| B、原氨水中有1%的含氮微粒为NH4+ |
| C、氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D、混合溶液中c(NH4+)+c(NH3?H2O)+c(NH3)=5×10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
34 16 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com