
【题目】下图微粒的结构示意图,正确的是( )
A. Mg2+ ![]() B. Cl
B. Cl ![]()
C. Ar ![]() D. K
D. K ![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应
4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出).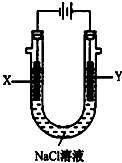
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.质子数和中子数相同的原子R,其阳离子Rn+核外共有x个电子,则R的质量数为
A. 2(x+n) B. 2(x-n) C. 2x D. n+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为 _________________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到______________(填现象) |
(2)综合上述实验现象和结论,______(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是__________________________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________________________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点________(填“正确”或“错误”),原因是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
4 | ⑩ |
(1)写出下列元素符号:④_______;________。
(2)画出原子的结构示意图:⑤_________;________。
(3)在①~元素中,金属性最强的元素是_________,非金属性最强的元素是_______,最不活泼的元素是________ (均填元素符号)。
(4)元素⑦与元素⑧相比,非金属性较强的是_______(用元素符号表示),下列表述中能证明这一事实的是___________(填序号)。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为_____。且该氧化物可溶解在强碱NaOH中其离子方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是( )
A.容量瓶中原有少量的蒸馏水
B.移液时,不慎将液体流到瓶外
C.容量瓶盛过KOH溶液,使用前未洗涤
D.定容时俯视刻度线和液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色强酸性溶液中,下列各组离子能够大量共存的是( )
A.NH4+、HCO3ˉ、Clˉ、K+
B.Clˉ、Na+、NO3ˉ、Ca2+
C.K+、Fe2+、Clˉ、NO3ˉ
D.Cu2+、NH4+、SO42ˉ、Clˉ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com