
【题目】我国重晶石(含BaSO490%以上)资源丰富,其中贵州省重晶石储量占全国总储量的三分之一。我省某工厂以重晶石为原料,生产“电子陶瓷工业支柱”—钛酸钡( BaTiO3)的工艺流程如下:

查阅资料可知:
①常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.5×10-9
②TiCl4在常温下是无色液体,遇水容易发生水解:TiC14+2H2O=TiO2+4HCl
③草酸氧钛钡的化学式为:BaTiO(C2O4)2·4H2O
请回答下列问题:
(1)工业上用饱和Na2CO3溶液处理重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为_________________,此反应的平衡常数K=__________(填写计算结果)。若不考虑CO32-的水解,则至少需要使用_______mol/L的Na2CO3溶液浸泡重晶石才能实现该转化过程。
(2)配制TiC14溶液时通常将TiC14固体溶于浓盐酸再加水稀释,其目的是______________。
(3)可循环使用的物质X是____________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:____________________。
(4)写出煅烧草酸氧钛钡晶体的化学方程式:______________________。
【答案】 BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) 0.04(或1/25) 2.5×10-4 抑制TiCl4的水解 HCl 取最后一次洗涤液少许,滴入稀硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净 BaTiO(C2O4)2·4H2O![]() BaTiO3 + 2CO2 +2CO +4H2O
BaTiO3 + 2CO2 +2CO +4H2O
【解析】根据流程图,用饱和Na2CO3溶液处理重晶石,将BaSO4转化为易溶于酸的BaCO3,然后用盐酸溶解后,加入TiC14和草酸溶液,反应析出草酸氧钛钡晶体,经过洗涤、干燥、灼烧得BaTiO3。其中将BaSO4转化为易溶于酸的BaCO3的离子方程式为BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),根据K=![]() =
=![]() 计算,当c(SO42-)≤1.0×10-5 mol/L时,可以认为BaSO4已转化为BaCO3,据此分析解答。
计算,当c(SO42-)≤1.0×10-5 mol/L时,可以认为BaSO4已转化为BaCO3,据此分析解答。
(1)工业上用饱和Na2CO3溶液处理重晶石,将BaSO4转化为易溶于酸的BaCO3,该过程用离子方程式可表示为BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq),此反应的平衡常数K=![]() =
=![]() =
=![]() =
=![]() ;当c(SO42-)≤1.0×10-5 mol/L时,认为BaSO4转化为了易溶于酸的BaCO3,因此c(CO32-)≥2.5×10-4mol/L,故答案为:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);
;当c(SO42-)≤1.0×10-5 mol/L时,认为BaSO4转化为了易溶于酸的BaCO3,因此c(CO32-)≥2.5×10-4mol/L,故答案为:BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq);![]() ;2.5×10-4;
;2.5×10-4;
(2)TiC14在常温下是无色液体,遇水容易发生水解可知,在配制为抑止其水解,需将TiCl4固体溶于浓盐酸再加水稀释,故答案为:抑制TiCl4的水解;
(3)向混合液中加入TiC14溶液和H2C2O4溶液反应得到草酸氧钛钡和HCl,故可循环使用的物质X 是HCl;草酸氧钛钡晶体表面附着氯离子,验证草酸氧钛钡晶体是否洗涤干净的方法为:取最后一次洗涤液少许,滴入稀硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净,故答案为:HCl;取最后一次洗涤液少许,滴入稀硝酸酸化的硝酸银,若无沉淀生成,则说明晶体已经洗涤干净;
(4)BaTiO(C2O4)24H2O煅烧,发生分解反应,由元素守恒可知,生成高温下的气体产物有CO、CO2、H2O(g),煅烧草酸氧钛钡晶体的化学方程式为BaTiO(C2O4)2·4H2O![]() BaTiO3 + 2CO2 +2CO +4H2O,故答案为:BaTiO(C2O4)2·4H2O
BaTiO3 + 2CO2 +2CO +4H2O,故答案为:BaTiO(C2O4)2·4H2O![]() BaTiO3 + 2CO2 +2CO +4H2O。
BaTiO3 + 2CO2 +2CO +4H2O。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】下列有关Cl2的说法中,不正确的是
A. Cl2是一种黄绿色的有毒气体 B. 干燥的Cl2可保存在钢瓶中
C. 铁丝在Cl2中燃烧生成FeCl3 D. 氯气和液氯是两种不同的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l) 能自发进行,则其ΔH<0
B. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
C. 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以化合物A为原料合成化合物M的线路如下图所示。

(1)写出化合物B中含氧官能团的名称为________________。
(2)①的反应类型为________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式_____________。
①能与FeCl3发生显色反应; ②分子中有3种不同化学环境的氢;
(4)E与Y反应生成M同时还生成甲醇,写出Y(C5H8O4)的结构简式__________________。
(5)以苯酚、乙醇、![]() 为有机原料合成
为有机原料合成 ,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
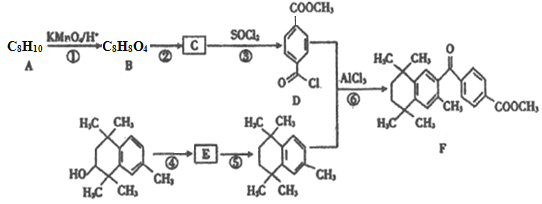
已知:I. 
Ⅱ. ![]()
回答下列问题:
(1)B的名称是______________。
(2)反应⑤所属的反应类型为______________。
(3)反应⑥的化学方程式为___________________________。
(4)芳香族化合物X是C的同分异构体,只含一种官能团且1molX与足量 NaHCO3溶液发生反应生成2 molCO2,则X的结构有_______种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的结构简式为______________。
(5)写出以乙醇和甲苯为原料制备 的路线(其他无机试剂任选)___________________。
的路线(其他无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g) ![]() CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a.升高温度 b.加入催化剂 c.增大压强 d.及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变 b.v(H2)=2 v(CO)
c.CO的物质的量分数保持不变 d.容器内气体密度保持不变
e.每生成1molCH3OH的同时有2molH-H键断裂
(4)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图所示,图中CH3OH从__________(填A或B)通入,b极的电极反应式是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中所含c(Cl-)最大的是
A. 50mL0.1mol·L-1AlCl3溶液 B. 100mL0.1 mol·L-1MgCl2溶液
C. 150mL0.3 mol·L-1KClO3溶液 D. 200mL0.2 mol·L-1NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com