
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,增大压强,平衡正向移动提高反应物的转化率,故A不选;
B.催化剂的选用平衡不移动,所以不能用勒夏特列原理解释,故B选;
C.反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应)达平衡后,升高温度,平衡逆向移动,体系颜色变深,能用勒夏特列原理解释,故C不选;
D、存在Cl2+H2O?HCl+HClO,生成的次氯酸见光分解,促进平衡正向进行,故氯水光照后颜色变浅,能用勒夏特利原理解释,故D不选;
故选B.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:填空题
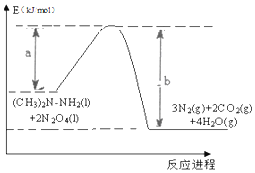 2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.
2016年10月17日上午,长征二号F型运载火箭在酒泉卫星发射中心腾空而起,成功将宇航员和“神舟十一号”飞船送入太空.火箭使用偏二甲肼【(CH3)2N-NH2】和四氧化二氮【N2 O4】作为燃料.化学反应热量变化图象如图所示:此反应的热化学方程式为:(CH3)2N-NH2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=(a-b)KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5 mol | B. | 5.5 mol | C. | 3 mol | D. | 2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
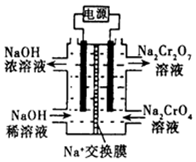 铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.
铬是用途广泛的金属元素,但在生产过程中易产生有害的含铬工业废水.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:
现用18mol/L的浓H2SO4来配制100mL 3.6mol/L的稀硫酸.可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个H2的质量比等于14:1 | |
| C. | 1 mol臭氧和1.5 mol氧气含有相同数目的氧原子 | |
| D. | 常温、常压下,0.5×6.02×1023个一氧化碳分子质量是28 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com