
分析 (1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,再根据v=$\frac{△c}{△t}$计算用A、B表示的反应速率;
(2)根据浓度据转化之比等于化学计量数之比;
(3)根据方程式计算消耗B的物质的量,B的转化率=$\frac{反应消耗B的物质的量}{反应前B总的物质的量}$×100%计算.
解答 解:(1)反应2min 时,A的浓度减少了$\frac{1}{3}$,则△c(A)=$\frac{1}{3}$×$\frac{amol}{2L}$=$\frac{1}{6}$amol/L,则v(A)=$\frac{\frac{1}{6}amol/L}{2min}$=$\frac{a}{12}$ mol/(L•min);B的物质的量减少了$\frac{a}{2}$mol,则△c(B)=$\frac{\frac{a}{2}mol}{2L}$=$\frac{a}{4}$mol/L,v(B)=$\frac{\frac{a}{4}mol/L}{2min}$=$\frac{a}{8}$mol/(L•min),
故答案为:$\frac{a}{12}$ mol/(L•min);$\frac{a}{8}$mol/(L•min);
(2)根据(1),△c(A)=$\frac{1}{6}$amol/L,△c(B)=$\frac{a}{4}$mol/L,由题vC=$\frac{1}{2}$vA;则△c(C)=$\frac{1}{2}$△c(A)=$\frac{a}{12}$mol/L,△c(C)=$\frac{amol}{2L}$=$\frac{a}{2}$mol/L,则x:y:p:q=$\frac{1}{6}$a:$\frac{1}{4}$a:$\frac{1}{12}$a:$\frac{1}{2}$a=2::1:6;
故答案为:x=2;y=3;p=1;q=6;
(3)反应达到平衡时,D为2amol,由方程式2A(g)+3B(g)=C(g)+6D(g)可知消耗的B为2amol×$\frac{3}{6}$=amol,故B的转化率为:$\frac{amol}{bmol}$×100%=$\frac{a}{b}$×100%,
故答案为:$\frac{a}{b}$×100%.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学反应速率、转化率等计算,根据反应速率关系以及物质的量的转化关系判断反应的化学方程式是解答该题的关键,试题培养了学生的化学计算能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | Cu(OH)2+2HCl═CuCl2+2H2O | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
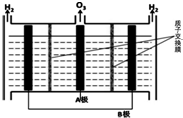 NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:
NO能引起光化学烟雾,破坏臭氧层.处理NO有多种方法,根据题意回答下列问题:| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过质谱法只能确认化合物的相对分子质量,一般无法确定其结构 | |
| B. | 甲苯分子的核磁共振氢谱中有2个不同的吸收峰 | |
| C. | 红外光谱可以帮助确定许多有机物结构 | |
| D. | 某有机物完全燃烧只生成CO2和H2O,两者的物质的量之比为1:2,则该有机物可能为甲烷或甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
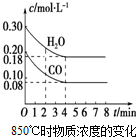 已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0
已知:CO(g)+H2O(g)?CO2(g)+H2(g);△H<0| 时间/min | c(CO)/mol•L-1 | c(H2O)/mol•L-1 | c(CO2)/mol•L-1 | c(H2)/mol•L-1 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.110 | 0.210 | 0.090 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HS-)+2c(S2-)+c(OH-) | |
| B. | c(H2S)+c(HS-)+c(S2-)=0.1 mol/L | |
| C. | 将上述溶液稀释至0.01 mol/L,c(H+)•c(OH-)不变 | |
| D. | c(S2-)+c(OH-)=c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数:N2<O2 | B. | 气体摩尔体积:N2<O2 | ||
| C. | 气体的压强:N2<O2 | D. | 体积:N2<O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
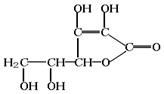
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com