
| A. | 向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸干得NaHCO3晶体 | |
| B. | 加热蒸发CuCl2饱和溶液得纯净的CuCl2晶体 | |
| C. | 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体 | |
| D. | 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3 |
分析 A.碳酸氢钠加热容易分解生成碳酸钠;
B.存在水解平衡:CuCl2+2H2O?Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行;
C.加入过量氯水,发生反应:2FeBr2+3Cl2=2FeCl3+2Br2,所得反应存在平衡:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸发时,Br2、HCl挥发,促进水解彻底进行;
D.氯化铁与氢氧化钠反应得到氢氧化铁,灼烧氢氧化铁分解得到氧化铁.
解答 解:A.碳酸钠能与二氧化碳反应生成碳酸氢钠,碳酸氢钠加热易分解生成碳酸钠,在减压、加热的条件下蒸发得NaHCO3晶体中混有碳酸钠,故A错误;
B.存在水解平衡:CuCl2+2H2O?Cu(OH)2+2HCl,加热蒸发,HCl挥发,促进水解彻底进行,最终得到Cu(OH)2,故B错误;
C.加入过量氯水,发生反应:2FeBr2+3Cl2=2FeCl3+2Br2,所得反应存在平衡:FeCl3+3H2O?Fe(OH)3+3HCl,加热蒸发时,Br2、HCl挥发,促进水解彻底进行,最终得到Fe(OH)3,故C错误;
D.氯化铁与氢氧化钠反应得到氢氧化铁,氢氧化铁加热分解生成三氧化二铁,故D正确;
故选D.
点评 本题考查实验制备方案评价,题目难度中等,注意BC中蒸发时氯化氢易挥发,使CuCl2、FeCl3水解完全得到氢氧化铜、氢氧化铁,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物溶于水显酸性 | |
| B. | Y的氧化物是离子化合物 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物可发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
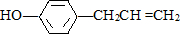 )的下列说法中正确的是( )
)的下列说法中正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中至少有7个碳原子处于同一个平面 | |
| C. | 它的部分同分异构体能与碳酸氢钠溶液反应产生气体 | |
| D. | 1mol该化合物最多可与2molBr2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅黄色 | |
| B. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| C. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,呈红色 | |
| D. | 该溶液中加入NaOH溶液,生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaBH4既是氧化剂也是还原剂 | |
| B. | NaBH4是还原剂,H2O是氧化剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | 被氧化的元素与被还原的元素质量比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注.
中药在世界医学界越来越受到关注.中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注. ,则其在周期表中的位置是第四周期,VA族.
,则其在周期表中的位置是第四周期,VA族.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com