
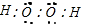 ,与高锰酸钾反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8 H2O+5O2↑,过氧化氢还可将碱性工业废水中的CN-氧化为碳酸盐和氨,方程式为:H2O2+CN-+OH-=CO32-+NH3,
,与高锰酸钾反应的离子方程式为:5H2O2+2MnO4-+6H+=2Mn2++8 H2O+5O2↑,过氧化氢还可将碱性工业废水中的CN-氧化为碳酸盐和氨,方程式为:H2O2+CN-+OH-=CO32-+NH3,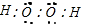 ;5H2O2+2MnO4-+6H+=2Mn2++8 H2O+5O2↑;H2O2+CN-+OH-=CO32-+NH3.
;5H2O2+2MnO4-+6H+=2Mn2++8 H2O+5O2↑;H2O2+CN-+OH-=CO32-+NH3.


科目:高中化学 来源: 题型:
| A、0.1mol?L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.3mol |
| B、常温常压下,22.4LO2所含的原子数小于2NA |
| C、标准状况下,11.2LCH3CH2OH中含有0.5NA个分子 |
| D、1.8g的NH4+离子中含有的电子数NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④ | B、②③⑤ |
| C、①③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+1s22s22p6 |
| B、F 1s22s22p5 |
| C、Cl-1s22s22p63s23p5 |
| D、Ar 1s22s22p63s23p6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、②和③ | B、仅有③ |
| C、仅有④ | D、以上都错 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com