
| A. | 酒精 | B. | 熔融的氢氧化钠 | C. | 液氯 | D. | 氯化钾晶体 |
分析 物质导电的原因:含有自由移动的离子或自由电子;
电解质是在水溶液里或熔融状态下能导电的化合物是电解质,包括酸、碱、盐、活泼金属氧化物和水;
非电解质是在水溶液里和熔融状态下都不能导电的化合物,包括一些非金属氧化物、氨气、大多数有机物(如蔗糖、酒精等);
解答 解:A.酒精是在水溶液里和熔融状态下都不能导电的化合物,属于非电解质,故A错误;
B.熔融的氢氧化钠含有自由移动的离子,能够导电,在水溶液里或熔融状态下能导电的化合物,是电解质,故B正确;
C.液氯是单质,不是电解质,故C错误;
D.氯化钾晶体,不含自由移动的离子,不能导电,故D错误;
故选:B.
点评 本题考查了电解质的判断及物质导电的判断,熟悉电解质、非电解质的概念及物质导电的条件是解题关键,注意电解质不一定导电,导电的不一定是电解质,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )| A. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | b电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、Ag+ | B. | H+、HCO3-、Na+、Cl- | ||
| C. | Na+、OH-、Ba2+、CO32- | D. | Mg2+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
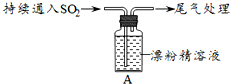 | i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构特点及元素、单质、化合物的性质 |
| X | 气态氢化物与最高价氧化物对应水化物可以化合成盐 |
| Y | 原子中s电子数与p电子数相同,且p电子的能量最高 |
| Z | 单质在空气中燃烧产生黄色火焰,生成黄色粉末 |
| W | 最外层电子排布(n+1)sn(n+1)pn-1 |
| T | 单质升华可以产生紫色的烟 |
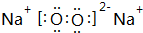 ;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.
;已知w 的氯化物在177.8°C时会发生升华现象,由此可以判断它的晶体类型为分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,15g甲基(-CH3)所含的中子数为6NA | |
| B. | 一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1L的碳酸钠溶液中,若c(CO32-)=1mol/L,则Na+个数为2NA | |
| D. | 含4NA个离子的固体Na2O2溶于水配成1L溶液,所得溶液中Na+的浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com