
 ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒.分析 (1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低;
(2)质量守恒,结合原子守恒和电子守恒写出该反应的化学方程;
(3)反应热与反应计量数呈正比,1mol Cl2参与反应时释放145kJ的热量,2mol Cl2参与反应时释放290kJ的热量,依据热化学方程式书写方法写出,标注物质聚集状态和对应焓变;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,
故答案为:氧化;
(2)质量守恒和原子守恒配平可得:2KClO3+SO2=2ClO2+K2SO4,
故答案为:K2SO4;
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,2mol氯气完全反应放热290 kJ,热化学方程式为2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ•mol-1,
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290 kJ•mol-1;
(4)①用氢氧化钠溶液调至中性,由图知,此条件下粒子种类为 ClO2,ClO2将加入的碘化钾氧化为I2,自身被还原成ClO2-,离子方程式为:2ClO2+2I-=2ClO2-+I2,故答案为:2ClO2+2I-=2ClO2-+I2.
②加入一定量 Na2S2O3 溶液,发生反应2S2O32-+I2═S4O62-+2I-,使I2还原为I-,故蓝色会消失,
故答案为:蓝色消失,半分钟内不变色;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~~~~I-~~~ClO2
1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为 $\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题考查了物质含量的测定、氧化还原反应、离子方程式的书写、有关方程式的计算,题目综合性较强,侧重于考查学生对基础知识的综合应用能力和计算能力,题目难度中等,注意把握物质含量的测定方法.


科目:高中化学 来源: 题型:选择题
| A. | 1mol CO(g)和1molH2O(g)充分反应,放出的热量为aKJ | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,速率加快,反应放出的热量不变 | |
| D. | 若将该反应设计为原电池,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 空气、Cl2 | B. | NaHCO3、蔗糖 | C. | Ba(OH)2、CH3CH2OH | D. | H2SO4、盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序为 W>Q>Z>X>Y | |
| B. | 元素 Y 与 W 对应氢化物的沸点 H2Y>H2W | |
| C. | 元素 X 与 Y 可以形成 5 种以上的化合物 | |
| D. | 元素 Q 的最高价氧化物对应的水化物酸性比 W 的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在点燃易燃气体前,必须检验气体的纯度 | |
| B. | 在稀释浓硫酸时,应将浓硫酸用玻璃棒引流慢慢注入水中 | |
| C. | 浓硫酸有腐蚀性,沾到皮肤上,应用较多的水冲洗,再涂上碳酸氢钠稀溶液 | |
| D. | 不得点燃添满酒精的酒精灯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
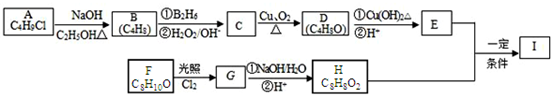
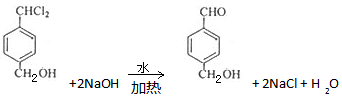
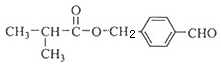 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com