
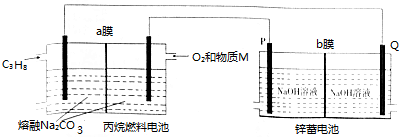
| A�� | ����MΪCO2 | |
| B�� | ȼ�ϵ������1mo1 O2ʱ����������4 mol OH-��bĤ��P�缫�ƶ� | |
| C�� | aĤ��bĤ������ѡ�������ӽ���Ĥ | |
| D�� | ��װ���У�п���ص�������ӦʽΪZn+2OH--2e-�TZnO+H2O |
���� ���װ���DZ��飨C3H8��������ȼ�ϵ�أ�������ԭ��أ�ԭ��طŵ�ʱ��ȼ��ʧ���ӷ���������Ӧ������Ͷ��C3H8�ĵ缫Ϊ������Ͷ��������������M�ĵ缫Ϊ�������������������õ��ӷ�����ԭ��Ӧ����ӦʽΪ��O2+2CO2+4e-=2CO32-���ұ�װ������ӵ�Դ�������ǵ��أ����Ӹ�����Q�缫������������������P�缫��������������ʧ���ӷ���������Ӧ�������ϵõ��ӷ�����ԭ��Ӧ���ݴ˷������
��� �⣺A�����װ���DZ��飨C3H8��������ȼ�ϵ�أ�������ԭ��أ�ԭ��طŵ�ʱ���������������õ��ӷ�����ԭ��Ӧ���������õ��Ӻ�M��Ӧ����̼������缫��ӦʽΪO2+2CO2+4e-=2CO32-������MΪCO2����A��ȷ��
B�����ݵ�ʧ�����غ㣬ȼ�ϵ������1mo1 O2ʱ����ת��4 mol ���ӣ�����������P�缫����������ӦʽΪ4OH--4e-�TO2+2H2O��������������4 mol OH-��bĤ��P�缫�ƶ�����B��ȷ��
C����Ϊ�����������õ��Ӻ�M��Ӧ����̼���������C3H8ʧ������������̼���������aĤѡ�������ӽ���Ĥ������������P�缫����������ӦʽΪ4OH--4e-�TO2+2H2O�����������������Ӹ�����Q�缫������������Ϊ����п�õ��ӷ�����ԭ��Ӧ��������������bĤ����ѡ�������ӽ���Ĥ����C��ȷ��
D����װ���У�п���طŵ�ʱ���ܷ�Ӧ�ֱ�Ϊ2Zn+O2�T2ZnO������ӦʽΪZn+2OH--2e-�TZnO+H2O����D����
��ѡD��
���� ���⿼����ԭ��غ͵��أ���ȷԭ��غ͵���ԭ���ǽⱾ��ؼ���֪�����ӵķŵ�˳����Ŀ�Ѷ��еȣ�


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | m��n��qһ���Ƿǽ���Ԫ�� | |
| B�� | �⻯��ķе㣺q��n��m | |
| C�� | ���Ӱ뾶�Ĵ�С��q��n��p | |
| D�� | m��q�γɵĶ�Ԫ������һ���ǹ��ۻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������ӵĵ���ʽ�� | B�� | NH4Br�ĵ���ʽ�� | ||
| C�� | Cl-�Ľṹʾ��ͼ�� | D�� | �������Ƶĵ���ʽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ�� | ���� | ���� |
| A | ̿���м���Ũ���Ტ���ȣ�����������ͨ����������ʯ��ˮ�� | �к���ɫ���������ʯ��ˮ����� | ��NO2��CO2���� |
| B | FeCl3��BaCl2�����Һ��ͨ������SO2 | ��Һ��Ϊdz��ɫ���а�ɫ�������� | ����ΪBaSO3 |
| C | �ƿ����ʯ�����ϼ��� | �ƿ��ۻ������յõ���ɫ���� | �۵㣺Na2O2��Na |
| D | �����е���Ũ���Ტ���Ͻ��� | ������ɫ���ɶ���� | Ũ���������ˮ�Ժ�ǿ������ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
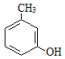 +CH3COCH2COOC2H5$��_{10�����12h}^{Ũ����}$
+CH3COCH2COOC2H5$��_{10�����12h}^{Ũ����}$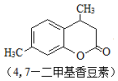 +C2H5OH+H2O
+C2H5OH+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ�� | ���� | ���� | |
| A | ��Ũ�Ⱦ�Ϊ0.1mol/L��NaHCO3��Һ��NaHSO3��Һ�еμӼ��η�̪�Լ� | ǰ����Һ��죬���߲���ɫ | NaHCO3ˮ�⣬��NaHSO3��ˮ�� |
| B | ��NaAlO2��Һ��ͨ��NH3 | ��ɫ���� | Al��OH��3�����ܽ��������� |
| C | �����Ʒ���ˮ��ͨ��SO2 | ��Һ��ɫ��ȥ | SO2���������� |
| D | ������NO2���ܱ���ƿ������ˮ�� | ��ƿ��������ɫ���� | NO2����N2O4�ķ�Ӧ�У���H��0 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� ����Ϊ3��5-����-4-�һ����� ����Ϊ3��5-����-4-�һ����� | |
| B�� | �������ɶԱ������ᣨPTA�����Ҷ�����EG��ͨ���Ӿ۷�Ӧ�õ��� | |
| C�� | �л��� CH3CH2CH��CH3��2 ��һ�ȴ����� 4 �� | |
| D�� | �����ǿ��Խ�һ��ˮ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �������⣨H2O2���׳�˫��ˮ����һ����Ҫ�Ļ�����Ʒ������Ư�ס�������������ɱ���ȶ��ֹ�Ч���㷺Ӧ���ڷ�֯����ֽ�����������ӡ��Ṥ����ˮ�����ȹ�ҵ���ش��������⣺
�������⣨H2O2���׳�˫��ˮ����һ����Ҫ�Ļ�����Ʒ������Ư�ס�������������ɱ���ȶ��ֹ�Ч���㷺Ӧ���ڷ�֯����ֽ�����������ӡ��Ṥ����ˮ�����ȹ�ҵ���ش��������⣺ ��
��| ʵ���� | �¶� | ���� | Ũ�� |
| ����ʵ��� | 25�� | ���������� | 10mL5%H2O2 |
| ����ʵ��� | 25�� | �������� | 10mL 5%H2O2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com