
| A. | 4种 | B. | 6种 | C. | 8种 | D. | 9种 |
分析 1molH与足量的碳酸氢钠反应生成CO2为2mol,说明H分子中含有2个-COOH,可以看作丁烷中2个H原子被-COOH取代,丁烷有正丁烷、异丁烷,H分子只含1个甲基,正丁烷被取代,其中1个羧基一定取代端位甲基上-COOH,移动另外的-COOH,若为异丁烷被取代,2个-COOH只能分别取代甲基上H原子.
解答 解:1molH与足量的碳酸氢钠反应生成CO2为$\frac{44.8L}{22.4L/mol}$=2mol,说明H分子中含有2个-COOH,可以看作丁烷中2个H原子被-COOH取代,H分子只含1个甲基,正丁烷(C-C-C-C)被取代,其中1个-COOH处于端位,另外的-COH有3种位置,异丁烷( )被取代,2个-COOH只能分别取代甲基上H原子,有1种,符合条件的同分异构体共有4种,
)被取代,2个-COOH只能分别取代甲基上H原子,有1种,符合条件的同分异构体共有4种,
故选:A.
点评 本题考查限制条件同分异构体书写、官能团的性质,注意利用取代法判断,较好的考查学生分析思维能力.


科目:高中化学 来源: 题型:解答题
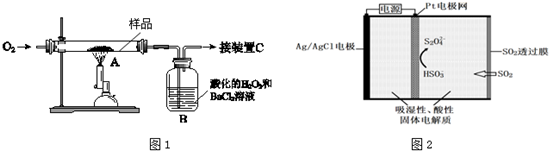
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯与氢气完全加成后的产物的一氯代物有5种 | |
| B. | 分子式为C4H9Br的卤代烃 (不考虑立体异构)有4种 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 用甘氨酸(H2N-CH2-COOH)和丙氨酸[CH3CH(NH2)COOH]脱水缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
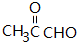 .
.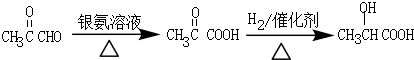 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Ca2+、Cl-、SO42- | B. | Fe2+、H+、CO32-、Cl- | ||
| C. | Mg2+、NH4+、Cl-、SO42- | D. | K+、Fe3+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 可与FeCl3溶液发生显色反应 | |
| B. | 分子中最少有4个碳原子共平面 | |
| C. | 能发生取代反应和银镜反应 | |
| D. | 与H2完全加成的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制标准溶液的NaOH中混有Na2CO3杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作正确 | |
| C. | 滴定前无气泡,滴定终了有气泡 | |
| D. | 配制标准溶液的Na0H中混有Na20杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
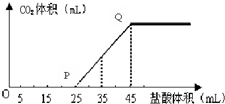 以下元素均为短周期元素:
以下元素均为短周期元素:| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是 内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
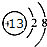 .
.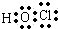 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com